Первый закон термодинамики. Первый закон термодинамики – это закон сохранения энергии в изолированной системе.
Первый закон термодинамики – это закон сохранения энергии в изолированной системе.
Теплота Q, переданная системе, идёт на увеличение её внутренней энергии ΔU и на совершение работы системой против внешних сил:
Q = ΔU + A (1)
Для бесконечно малого изменения величин:
δQ = dU + δA, (2)
бесконечно малое изменение функций состояния принято обозначать буквой d, а функций процесса – δ.
Внутренняя энергия - это общий запас энергии системы. Она включает в себя все виды энергии системы (энергию движения и взаимодействия молекул, атомов, ядер и др. частиц, внутриядерную и др. виды энергии), кроме кинетической энергии движения системы, как целого, и потенциальной энергии её положения. Абсолютную величину внутренней энергии измерить нельзя, можно определить её изменение при переходе системы из начального состояния в конечное. Внутренняя энергия представляет собой способность системы к совершению работы или передачи тепла.
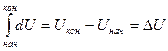 (3)
(3)
При увеличении внутренней энергии ΔU>0, при уменьшении ΔU<0.
Работа процесса – это энергия, передаваемая одним телом другому при их взаимодействии. В химической термодинамике обычно рассматривают работу расширения газа А = р · ΔV. Если система совершает работу, то величина А положительна, так как
ΔV = 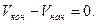
Поскольку работа является функцией процесса, то её изменение
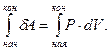 (4)
(4)
Для изохорных процессов, т.е. процессов, протекающих при постоянном объёме (V=const, dV=0):
δQv = dU, Qv = ΔU. (5)
Для изобарных процессов, протекающих при постоянном давлении (p=const, dp=0), выражение первого закона термодинамики можно преобразовать, если использовать функцию состояния системы, называемую энтальпией. Энтальпия H, как и внутренняя энергия, не зависит от пути процесса, характеризует полную энергию системы и «теплосодержание»:
H = U + pV;
dH = dU + d(pV) = dU + pdV + Vdp; (6)
при р=const, dp=0, Vdp=0
δQp = dU + pdV = (dH – pdV) + pdV = dH,
Qp = ΔH (7)
Для изотермических процессов,протекающих при постоянной температуре (T = const и U = const, dU = 0)
δQ = δA, Q = A. (8)
Для адиабатных процессов, при которых нет теплообмена системы с окружающей средой (δQ = 0):
δA = - dU, A = - ΔU. (9)
Дата добавления: 2014-12-07; просмотров: 1342;
