Методы формирования ядра изохинолина
Большинство изохинолинов синтезировано по одному из трёх главных методов построения кольца [14, 34].
1.1.1 Реакция Бишлера–Напиральского
Наиболее часто используемый метод синтеза изохинолинов носит название реакцииБишлера-Напиральского. Схема синтеза заключается в циклизации b-фенилэтиламидов под действием кислотного катализатора, в качестве которого используют фосфорный ангидрид с хлорокисью фосфора или полифосфорную кислоту. Эта реакция получения изохинолинов носит общий характер [9]. Обычно образующийся дигидроизохинолин превращают в изохинолин каталитическим дегидрированием – нагреванием в присутствии платинового катализатора.
Схема 1
| 190ᵒ С |

Циклизация по Бишлеру-Напиральскому, как и стадия циклизации в синтезе Скраупа, является ароматическим электрофильным замещением, в котором электрофилом является атом углерода протонированной карбонильной группы. Этим определяется характер влияния заместителя, находящегося в бензольном кольце, на скорость реакции, ее направление и выход целевого продукта. При взаимодействии мета-хлоранилина с глицерином в присутствии серной кислоты и мета-нитробензолсульфокислоты в качестве окислителя образуется примерно одинаковое количество 5-хлор- и 7-хлорхинолинов. В то же время, конденсация по Бишлеру-Напиральскому β-мета-метоксифенилацетамида приводит исключительно к 6-метоксипроизводному (выход 50%), 8-метоксипроизводное не образуется.
Схема 2


Протеканию циклизации по Бишлеру-Напиральскому не препятствует и введение в бензольное кольцо электроноакцепторной нитрогруппы, правда выход продукта циклизации при этом заметно снижается (< 10%). Следует отметить, что и не содержащий заместителя в бензольном кольце β-фенилацетамид циклизуется в соответствующее дигидропроизводное с выходом всего 23%. Низкий выход производных изохинолина компенсируется доступностью исходных соединений [10].
Механизм превращения ацилпроизводных β-фенилэтиламинов в дигидроизохинолины представлен на примере циклоконденсации соединения 1 [11].
Схема 3
| Ксилол, кипячение 1 час |


| 100% |
| 160ᵒ С, 1,5 часа |
| Полифосфорная кислота |
| 23% |

| Р2О5, пиридин |
| песок, кипячение |


| 76% |

Лучше всего идёт реакция, если ароматическое кольцо активизировано, и наоборот, низкий выход 7-нитро-3,4-дигидроизохинолина наглядно иллюстрирует отрицательное влияние дезактивирующих групп. Фенилэтиламины, замещённые в мета-положении, образуют только 6-изомеры изохинолинов, так как замыкание цикла идёт в пара-, а не в орто-положение по отношению к активирующей группе.
Модификация Пикте–Гамса. Если исходить из потенциально ненасыщенных фенилэтиламинов, то по методу Бишлера–Напиральского можно непосредственно получать ароматические изохинолины. С этой целью β-метокси- или β-окси-β-фенилэтиламиды нагревают с обычно применяемыми конденсирующими агентами. Надо думать, что при этом сначала отщепляется метанол (или вода), а затем происходит циклизация образовавшегося ненасыщенного амида в изохинолин [4, 12].
Схема 4
| CHCl3/Δ |
| POCl3 |

Пример изохинолинового синтеза
Схема 5
| Na – Hg / H2O / 50ᵒC |
| Ксилол / Δ 5 мин. |
| 75% |
| EtONa/EtOH, 20ᵒC |
| AmONO |

| MeCOCl |
| AlCl3/CS2/Δ |
| KOH/20ᵒC |
| 30% |
| P2O5 |
| 60% |
| HCl/20ᵒC |
| 60% |

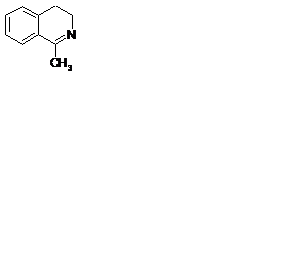
1.1.2 Реакция Пикте–Шпенглера
Большое значение в синтезе алкалоидов, являющихся производными изохинолина, имеет методПикте-Шпенглера, в котором в циклизацию вводят не ацетамидные производные, как в методе Бишлера-Напиральского, а имины, образующиеся при взаимодействии альдегидов с β-фенилэтиламинами в кислой среде [16, 12]. Синтез тетрагидроизохинолинов по методу Пикте–Шпенглера можно рассматривать как частный случай реакции Манниха. Процесс протекает в равной степени хорошо как с первичными, так и с вторичными аминами. В соответствии с условиями реакции первоначально образуется имин (в случае вторичного амина – енамин), который далее под влиянием кислоты протонируется, и возникающее положительно заряженное промежуточное соединение подвергается внутримолекулярному электрофильному замещению. Механизм этого процесса весьма сходен с механизмом реакции Бишлера–Напиральского, за исключением того, что конденсирующий агент не регенерируется на последней стадии. Благодаря такому сходству влияние заместителей в ароматическом кольце на скорость и направление циклизации в обоих случаях аналогично [13]. При протонировании атома азота образуется иммониевое соединение – сравнительно слабый электрофил, для успешной циклизации которого необходимо присутствие мощных активирующих группировок в ароматическом кольце. Влияние метоксигруппы оказывается достаточным только в том случае, если она находится в пара-положении к месту, по которому происходит замыкание; при наличии этой группы в других положениях кольца циклизация не идёт. В том случае, когда в бензольном кольце присутствуют активирующие заместители, реакция циклизации происходит в очень мягких, иногда даже в физиологических условиях (рН среды, температура, концентрации реагентов), и приводит к гидрированным производным изохинолина с высоким выходом [14, 7].Это напомнило о высказанных ранее предположениях о биогенезе тетрагидроизохинолиновых алкалоидов, согласно которым лабораторные синтезы по методу Пикте–Шпенглера воспроизводят условия биосинтеза алкалоидов в клетках растений. Однако впоследствии такая точка зрения не подтвердилась: теперь стало известно, что в природных условиях биосинтез изохинолиновых алкалоидов катализируется ферментами и осуществляется по более сложной схеме, чем это предполагалось ранее.
Схема 6

| тетрагидроизохинолин не образуется |
| водн. СН2О |

Таким образом, направление этой реакции замыкания гетероцикла совпадает с направлением синтеза Бишлера–Напиральского: она осуществляется благодаря электрофильной атаке по пара-, а не орто-положению к активирующей групперовке.
Два этих метода (1.1.1) и (1.1.2) основаны на конденсации фенилэтиламина с альдегидом или кислотой с последующей циклизацией в присутствии кислот. По такой общей схеме можно получать ди- и тетрагидроизохинолины. И те и другие легко дегидрируются до ароматических соединений. Из мета-замещённых фениламинов этими двумя методами можно синтезировать изохинолины с заместителями только в положении 6. Кроме того, они позволяют синтезировать изохинолины, замещённые любыми алкильными и арильными группами по положению 1. Но если у бензольного кольца исходного фенилэтиламина имеются электроноакцепторные группировки, то оба эти метода непригодны для синтеза изохинолинов [15].
Дата добавления: 2014-12-30; просмотров: 1304;
