Тампонада сердца
Редко встречающееся, но угрожающее жизни осложнение. Частота - 0,3 – 2% случаев всех катетеризаций. Летальность 67 – 100%, возникает в различные сроки – от нескольких часов до 38 дней.
Механизмы тампонады:
-механическое повреждение стенок сердца или сосудов пункционной иглой, кончиком катетера или проводника;
-эрозия сосуда вследствие контакта с катетером;
-осмотическое повреждение миокарда или стенок сосудов гипертоническими растворами;
-повреждение миокарда вследствие стафилококкового сепсиса, гипоальбуминемии, анемии;
Основные клинические признаки тампонады сердца:
-внезапное ухудшение состояния;
-острая сердечно-сосудистая, дыхательная недостаточность;
-резкое повышение ЦВД, набухание вен шеи;
Диагноз уточняется при допплерэхокардиографии.
После установки диагноза больному показан срочный перикардиоцентез с удалением содержимого из перикарда, извлечение центрального венозного катетера, иногда может понадобиться перикардиотомия с ушиванием раны сердца.
СПИСОК ЛИТЕРАТУРЫ:
1. М. Роузен, Я.П. Латто, У. Шэнг Нг. Чрескожная катетеризация центральных вен . М., Медицина. –1986. – 196с.
2. Г. Чен, Х.Е. Сола, К.Д. Лиллемо. Руководство по технике врачебных манипуляций. Витебск. Белмедкнига. –1996г. – 384 с.
3. В.П. Сухоруков, А.С. Бердикян. С.Л. Эпштейн. Пункция и куатетеризация вен. // Вестник интенсивной терапии, 2001 г, N3, -с.82 – 88.
4. Е.М. Шулутко. Осложнения катетеризации центральных вен. Пути снижения риска. // Вестник интенсивной терапии, 1999 г, 2, - с. 38 –44.
5. Е.М. Шулутко. Современные подходы к обеспечению венозного доступа для проведения инфузионно-трансфузионной терапии и экстракорпоральных манипуляций с кровью.// Гематология и трансфузиология, 1998 г., т.43, N 6, - с 38 – 39.
6. Saint S., Savel R.N., Matthay A. Enhancing the safety of critically ill patients by reducing urinary and central venous catether-related infections // Amer. J. Respir. Crit. Care Med. – 2002. – Vol. 165. – P.1475 – 1478.
3.1.45.
ТЕМА: КЛИНИЧЕСКАЯ ОЦЕНКА ПРЕДОПЕРАЦИОННОГО СОСТОЯНИЯ БОЛЬНОГО И ВЫБОР МЕТОДА АНЕСТЕЗИИ(Канус И.И.)
УЧЕБНЫЕ ВОПРОСЫ:
1. Стандарты предоперационного обследования больных.
2. Посистемная оценка состояния больных.
3. Классификация физического состояния больных по ASA.
4. Группы анестезиологического риска по ААА.
Предоперационная оценка складывается из сбора информации о больном и составления плана анестезии. Общая задача заключается в снижении осложнений и смертности в результате лечебных действий.
В идеале, предоперационная оценка выполняется специалистом, который будет проводить анестезиологическое пособие. Анестезиолог должен ознакомиться с хирургическим диагнозом, определить вовлеченные в патологический процесс системы органов, выяснить характер планируемого вмешательства. Во время беседы, объективного обследования и знакомства с имеющейся медицинской документацией определяют физический и психический статус больного. Регистрируются текущие медицинские назначения и собирается весь лекарственный аллергологический анамнез. Пациента следует спросить о курении, употреблении алкоголя и наркотических веществ. Информация о предшествующих наркозах представляет особый интерес - выясняются детали любых анестезиологических осложнений, проблем с интубацией, отсроченного пробуждения, злокачественной гипертермии, продленной нейромышечной блокады или наличия в послеоперационном периоде эпизодов тошноты и рвоты. Исходя из полученных данных, анестезиолог решает, есть ли необходимость в дополнительном предоперационном обследовании или консультациях, затем формулирует план анестезиологического пособия.
Информированное согласие. Обсуждаются альтернативы, потенциальные осложнения, соотношение риск/эффективность и на вопросы больного даются полные ответы. Если беседа проводится специалистом, который в дальнейшем не будет проводить анестезию, пациента следует предупредить об этом и объяснить, что вся полученная информация будет передана лечащему анестезиологу. Хорошо проведенная предоперационная оценка способствует формированию доверительных взаимоотношений доктор-больной, что значительно уменьшает тревожность пациента и в известной степени влияет на послеоперационное восстановление и исход лечения.
Классификация ASA была создана в 1940 г. для целей статистических исследований и стационарных записей. Она применима среди анестезиологов для сравнения результатов и в качестве удобного средства сообщения о состоянии объективного статуса больного. К несчастью, она не вполне ясна, и один пациент может быть отнесен к разным классам разными анестезиологами. Кроме того, более высокий класс по ASA только приблизительно предсказывает анестезиологический риск.
Согласно последней модификации 1961 г. существует 5 классов:
Класс 1 — здоровый пациент, медицинские проблемы отсутствуют.
Класс 2 — легкое системное заболевание.
Класс 3 - серьезное системное заболевание, в стадии компенсации.
Класс 4 — серьезное системное заболевание, постоянная угроза для жизни.
Класс 5 - умирающий больной, не ожидается выживания в течение 24 ч после операции.
Пометка «Э» добавляется к номеру класса, если операция экстренная.
Современная практика показывает необходимость оценки ротоглотки и подбородочной области. Ротоглотку исследуют в положении больного сидя с разогнутой шеей, при высунутом языке и в момент фонации. Выделяют четыре класса ротоглотки, впервые описанные Mallampati, сгруппированные соответственно визуализируемым структурам.
Класс I- мягкое небо, зев, язычок, передние и задние небные дужки.
Класс II— мягкое небо, зев, язычок.
Класс III— мягкое небо, основание язычка.
Класс IV— только мягкое небо.
Класс I Класс IV
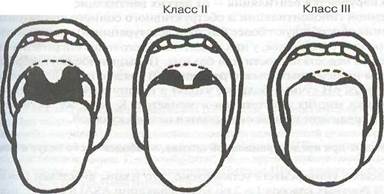
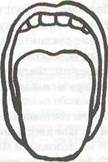
Подбородочной областью называется пространство между щитовидным хрящем и внутренней стороной подбородка, которое измеряют у пациентов в положении сидя при вытянутой вперед шее.
Mallampati обнаружил корреляцию между повышением орофарингеального класса и снижением степени визуализации голосовой щели при ларингоскопии. Позднее Benumof продемонстрировал, что более высокий орофарингальиый класс, сочетавши иен с подбородочным расстоянием менее 2 поперечных пальцев, лучше предсказывает увеличение трудностей при интубации. Другие характерные особенности, свидетельствуюшие о повышенной вероятности трудной интубации, включают нарушение разгибания шеи, снижение растяжимости тканей, большой язык, крупные верхние резцы, узкий свод неба, снижение подвижности височно-нижнечелюстного соединения, короткая толстая шея.
Современные рекомендации для взрослых без факторов риска аспирации - исключение приема твердой нищи в течение 6-8 ч; пероральная премедикапия вместе с небольшим глотком воды может назначаться за 1 -2 ч до анестезии.
Стандартные рекомендации для детей следующие:
- младенцам <6 мес. чистую воду дают не менее чем за 2 ч до операции.
- твердую еду и молоко - не менее чем за 4 ч до операции дают младенцам <6 мес.; не менее чем за 6 ч — детям от 6 мес. до 3 лет; не менее чем за 8 ч - детям старше 3 лет.
К группе высокого риска относятся больные с любым нарушением проходимости пищеварительного тракта, эпизодами гастроэзофагеального рефлюкса, диабетом (парез желудка), фактом недавнего приема твердой пищи, повышенным внутрибрюшным давлением (ожирение, асцит), беременностью, угнетенным сознанием или фактом недавнего назначения опиоидов (снижение скорости опорожнении желудка). Кроме того, факторами высокого риска аспирации являются назо-орофарингеальное или гастродуоденальное кровотечение, травма дыхательных путей, срочное оперативное вмешательство.
Ожирение определяется как превышение расчетной идеальной массы тела более чем и 20%. У больных с ожирением чаще встречаются диабет, гипертензия, ИБС. У пациентов этой группы чаще возникают трудности с проведением масочной вентиляции и с интубацией. При ожирении уменьшается функциональная остаточная емкость, повышается потребление О2и продукция СО2, часто нарушается вентиляция - от легких вентиляционно-перфузионных расстройств до выраженной гиповентиляции и обструктивного сонного апноэ. Эти изменения способствуют более быстрой десатурации во время апноэ. Если больные страдают пиквикским синдромом, у них может быть легочная гипертензия с проявлениями правожелудочковой недостаточности или без них. Повышенное внутрибрюшное давление связано с развитием пищеводных грыж и рефлюкса. В связи е повышенным желудочным объемом и пониженным рН тучные больные входят в гpyппy риска аспирационных осложнений.
В исследовании Флоридского университета установлено, что планы анестезии менялись у 20% больных (включая 15% больных классов 1 и 2 но классификации ASA) в связи с выявлением при предоперационной оценке различных патологических состояний. Наиболее распространенными были желудочный рефлюкс, инсулинзависимый диабет, астма и ожидаемые трудности при интубации. Эти данные подтверждают, что по возможности предоперационный осмотр больных следует проводить раньше, чем за день до оперативного вмешательства.
Предоперационные консультации подпадают под две основные категории:
1. Больные, у которых для установления диагноза (или диагнозов) требуется больший объем информации или компетентности, а результаты дополнительного исследования повлиять на проведение анестезии.
2. Пациенты, у которых диагноз установлен, но требуется дальнейшее обследование и лечение для оптимизации их состояния перед хирургическим вмешательством.
Примером первого типа консультации было бы обследование кардиологом 50-летнего больного с недавним эпизодом болей в грудной клетке, связанным с напряжением. Консультация специалистом-терапевтом больного с плохо контролируемым диабетом, гипертонией или астмой - хорошие примеры второго типа консультаций.
Угарный газ (СО), входящий в состав сигаретного дыма, снижает доставку кислород к тканям. Никотин приводит к увеличению ЧСС и может вызывать периферическую вазоконстрикцию. В течение 12-24 ч после отказа от курения, уровни СО и никотина возвращаются к норме. Дренажная функция бронхов улучшается в течение 2—3 дней, а продуцирование мокроты снижается до нормального уровня примерно за 2 нед. Тем не менее, исследования не продемонстрировали значительного снижения частоты послеоперационных респираторных осложнений при сроке отказа от курения до 6-8 нед.
Распознавание потенциально опасных сердечных заболеваний (ИБС, застойная сердечная недостаточность и аритмии) основывается на данных анамнеза, объективного обследования и интерпретации ЭКГ. Кроме определения наличия болезни, необходимо уточнить ее тяжесть, стабильность течения и предшествующее лечение. Другие факторы, имеющие значение в определении кардиального риска, включают функциональные резервы, возраст, сопутствующую патологию (например, сахарный диабет, гипертонию, хронические заболевани почек, периферические сосудистые заболевания и др.) и инвазивность планируемого хирургического вмешательства.
Регионарная анестезия у больных, получающих антикоагулянты, должна выполняться только тогда, когда соотношение успех/риск в этом случае предпочтительнее, чем при альтернативных методах. У больных с искусственным клапаном сердца прерывание антикоагу-лянтной терапии несет реальный риск клапанного тромбоза и развития эмболии. Следовательно, при расчете времени существуют ограничения, связанные с достижением коагуляционного «окна», достаточно короткого для исключения патологических тромбозов и достаточно длительного для исключения нейроаксиальных кровотечений. Пероральные антикоагулянты следует отменить за 3-5 дней до хирургического вмешательства с одновременным началом внутривенной терапии гепарином. Введение гепарина прекращается за 4-6 ч до спи-нальной или эпидуральной анестезии и не возобновляется по меньшей мере в течение 1 ч для исключения образования эпидуральной гематомы. Если существует вероятность хирургического кровотечения, отсрочка должна составлять не менее 12 ч до возобновления терапии гепарином.
Пациенты с частыми эпизодами гипогликемии и кетоацидоза («хрупкие» диабетики) с большей вероятностью будут метаболически нестабильны в периоперационном периоде. Если больной длительное время плохо контролировал уровень гликемии, у него, вероятно, имеются заболевания органов-мишеней. Так, анестезиологу следует искать проявления ишемической болезни сердца (часто «немой»), гипертензии, вегетативной нейропатии (контроль ортостатических изменений основных показателей жизнедеятельности организма), почечной недостаточности, кардиомиопатии и пареза желудка. Узнайте, какие препараты больной принимает для лечения диабета, наибольшую последнюю дозу и последний уровень гликемии. У некоторых больных может встречаться нарушение разгибания шеи, обусловленное вовлечением атланто-окципитального сочленения в синдром тугоподвижности суставов.
Тяжелые предоперационные метаболические расстройства часто наблюдаются у инсулин-зависимых больных, особенно при наличии травмы или инфекции. Ищите высокий или низкий уровни глюкозы, электролитные расстройства, кетоацидоз, гиповолемию и гиперос-молярность.
В предоперационное обследование следует включить, как минимум, определение уровня глюкозы, электролитов, азота мочевины крови, креатинина, анализ мочи и ЭКГ. Дополнительными лабораторными исследованиями могут быть определение газов артериальной крови, кетоновых тел, осмолярности, уровней кальция, фосфора и магния.
Алкоголизм является полиорганным заболеванием. Отмечается повышенная устойчивость ЦНС к ингаляционным анестетикам и препаратам для индукции. В периоперационном периоде могут развиться судороги отмены или делирий. У некоторых алкоголиков отмечается парадоксальное возбуждение при назначении седативных препаратов и гипнотиков. Могут выявляться признаки периферической нейропатии, что имеет значение при применении регионарной анестезии. Изменения со стороны сердечно-сосудистой системы характеризуются
высокой частотой гипертензии и алкогольной кардиомиопатии (проявляющейся хронической сердечной недостаточностью, аритмиями, повышенной чувствительностью к кардиодепрессивным свойствам ингаляционных анестетиков). Проблемы со стороны желудочно-ки шечного тракта включают гастриты, кровотечения, гепатиты и панкреатиты.
Хроническое употребление алкоголя приводит к повышению метаболической активности печени с повышением устойчивости к местным анестетикам, седативным препаратам) анальгетикам и некоторым миорелаксантам. Наоборот, при последующем нарушении функций печени наблюдается усиление действия препаратов, а также развитие коагулопатии и, возможно, варикозного расширения вен пищевода. Метаболические расстройства и нарушения питания ведут к дефициту тиамина, гипофосфатемии, гипомагниемии и гипокальцие мии. Наконец, у алкоголиков могут появляться лейкопения и анемия, а при наличии поражения печени, кроме коагулопатии, могут развиваться тромбоцитопатия и предрасположенность к ДВС-синдрому.
Группы анестезиологического риска по ААА
I. Пациенты, не имеющие заболеваний или имеющие только легкое
заболевание, которое не приводит к нарушению общего состояния .
П. Пациенты, имеющие легкие или умеренные нарушения общего состояния связанные с хирургическим заболеванием, которые только умеренно нарушают нормальные функции и физиологическое равновесие (легкая анемия 10-12 г/%, повреждение .миокарда на ЭКГ без клинических проявлений, начинающаяся эмфизема, легкая гипертензия).
III. Пациенты с тяжелыми нарушениями общего состояния, которые связаны с хирургическими заболеваниями и могут значительно нарушать нормальные функции (например, сердечная недостаточность или нарушение дыхательной функции в связи с эмфиземой легких или инфильтративными процессами).
IV. Пациенты с очень тяжелым нарушением общего состояния, которое может быть связано с хирургическими страданиями и приносят ущерб жизненно важным функциям или угрожают жизни (сердечная декопенсация, непроходимость и т.д. - если пациент не относится к группе VII).
V. Пациенты, которые оперируются по экстренным показаниям и принадлежат к I или II группе по нарушению функций.
VI. Пациенты, которые оперируются по экстренным показаниям и принадлежат к III или IV группам.
VII. Пациенты, умирающие в ближайшие 24 часа как при проведении оперативного вмешательства и анестезии, так и без них.
СПИСОК ЛИТЕРАТУРЫ:
5. Дамир Е.А., Гуляев Г.В. Основы практической анестезиологии. М. 1967.
6. Бунятян А.А., Рябов Г.А., Маневич А.З. Анестезиология и реаниматология. М. 1984.
7. Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии. М. 1984.
8. Э.Морган Клиническая анестезиология 2. С.-Петербург. 2000.
3.1.47.
ТЕМА: ГЕМОРРАГИЧЕСКИЙ ШОК И МЕТОДЫ ВОСПОЛ- НЕНИЯ КРОВОПОТЕРИ(Канус И.И.)
УЧЕБНЫЕ ВОПРРОСЫ:
1.Этиология и патогенез развития геморрагического шока.
2.Клиника геморрагического шока.
3.Диагностика острой кровопотери оценка тяжести состояния
4.Методы интенсивной терапии.
Чтобы изложить современные представления о механизмах развития шока, следует избрать соответствующую модель. Этому требованию максимально удовлетворяет геморрагический шок, поскольку в наиболее чистом виде отражает состояние малого выброса.
Патогенез. Отражая прагматичность современных подходов к трактовке патофизиологических механизмов в развитии критических синдромов, Levis (I975) дает следующее определение: "Шок является состоянием гипоперфузии, возникшим вторично в связи со снижением эффективно циркулирующего объема крови". Еще ранее близкое определение дал Cohn (I970): "Шок является синдромом, характеризующимся критическим снижением кровотока в тканях". Пожалуй, это наиболее четкие, хотя и общие, определения того, что происходит в организме при шоке.
Пусковым механизмом в развитии шока является так называемый синдром малого выброса, приводящий в конечном счете к снижению перфузии тканей и органов. Однако задолго до развития биохимических сдвигов, развивающихся в результате тканевой гипоперфузии, возникает целый ряд неспецифических эндокринных сдвигов компенсаторной направленности. Гипоперфузия и гипотензия являются также пусковым моментом для освобождения AКTГ, альдостерона и АДГ, в результате чего происходит задержка почками натрия, хлоридов и воды при сопутствующем увеличении потерь калия и уменьшении диуреза. Освобождение адреналина и норадреналина приводит к периферической вазоконстрикции. Острая потеря 50% объема крови у молодого здорового субъекта приводит к острой циркуляторной недостаточности и развитию картины глубокого шока. Следует, однако, учитывать, что для возникновения шока имеет значение не только сила воздействия (в данном случае объем кровопотери), но и фактор времени: хроническая гиповолемия, даже если она значительна, не вызывает катастрофических нарушений гемодинамики, хотя и является потенциально опасным состоянием. Шок развивается, как правило, не столько в связи с уменьшением ОЦК и его компонентов (даже если возникающий дефицит крови значителен), сколько в результате интенсивности кровопотери.
Основной емкостью крови в организме является венозная система (так называемая система малого давления), вмещающая до 75% объема крови; в связи с этим кровопотеря отражается, прежде всего, на объеме крови в венах. Венозные сосуды обладают хорошо развитым моторным механизмом, позволяющим быстро приспосабливать емкость системы к изменившемуся объему крови. До тех пор пока действует этот адаптационный механизм, ЦВД остается в прежних пределах и венозный возврат не меняется. Однако эти возможности ограничены, и при потере 5-10% ОЦК начинает падать ЦВД и венозный возврат уменьшается. Это ведет к снижению сердечного выброса. Организм стремится компенсировать недостаточный венозный возврат нарастающей тахикардией. Минутный объем сердца при этом может довольно долго оставаться на прежнем уровне или даже повышаться. При истощении компенсаторного емкостного механизма, которое наступает с уменьшением венозного возврата на 25-30%, начинает снижаться сердечный выброс - развивается синдром малого выброса.
Адаптационные и компенсаторные реакции организма при любых условиях снижения объемного кровотока направлены прежде всего на сохранение удовлетворительного кровоснабжения жизненно важных органов - мозга, сердца, печени и почек. При невозможности поддержания нормального кровотока перечисленными механизмами развивается следующий этап компенсации - периферическая вазоконстрикция, обеспечивающая поддержание артериального давления на уровне, выше критического. Феномен этот известен под названием "централизация кровообращения".
Большое место в комплексе патологических сдвигов, возникающих в связи с кровопотерей, занимает перемещение жидкости из сосудистого и внеклеточного сектора в клеточный. Хотя эти перемещения по своим абсолютным значениям невелики и составляют лишь 5-8% объема внутрисосудистой жидкости, они означают наступление необратимой фазы шока.
Lefer, Martin (1970) обнаружили, что при геморрагическом шоке в крови животных появляются по крайней мере шесть пептидов с молекулярной массой 800-1000, оказывающих угнетающее влияние на миокард. Наиболее выраженный отрицательный инотропный эффект вызывал один из них (D-пептид). Сумма воздействий этих пептидов названа фактором, угнетающим миокард, - МDF (miocardial depressant factor).
На основании экспериментальных работ Lefer(1970) пришел к выводу, что протеазы, способные катализировать продукцию MDF, образуются в бассейне сосудов брюшной полости и транспортируются в системную циркуляцию через грудной лимфатический проток, где непосредственно и начинается продукция этого фактора. Помимо описанных гиповолемических состояний, связанных с кровопотерей, MDF образуется также в больших количествах при эндотоксиновом шоке, изолированной ишемии сосудов брюшной полости, а также при геморрагическом и некротическом панкреатите. Во всех случаях накопление MDF в плазме может быть предупреждено введением больших доз глюкокортикоидов, местными анестетиками, дренированием грудного лимфатического протока, частично гемодиализом и, наконец, введением ингибиторов протеолитической активности.
Важным в формировании шока представляется нарушение хода метаболических процессов. При нормальном кровообращении клетки утилизируют глюкозу с помощью аэробного гликолиза и в цикле лимонной кислоты, получая при этом энергию путем образования АТФ. При недостатке кислорода блокируется нормальный путь в цикле Кребса и пировиноградная кислота начинает анаэробным путем превращаться в молочную кислоту. Избыток последней приводит к развитию ацидоза. Накопление аминокислот и жирных кислот, нормальная оксигенацкя которых при шоке нарушается, также способствует углублению ацидоза. Дефицит кислорода и ацидоз усиливают процесс выхода калия из клетки и проникновения в нее натрия и воды. Нарастающий отек клетки также в значительной степени нарушает нормальный ход метаболических процессов в ней.
Клиника. Известные трудности представляет решение вопроса о том, развился ток или еще нет. Обычно такой вопрос возникает лишь при оценке пограничных состояний, когда, еще отсутствует гипотензия, но налицо все признаки кровопотери.
Исходя из сказанного по поводу патогенеза, мы считаем целесообразным выделять следующие стадии в развитии геморрагического шока:
I - компенсированный обратимый шок (синдром малого выброса),
П - декомпенсированный обратимый ток,
Ш - необратимый ток.
Очевидно, что не каждый больной с кровопотерей должен пройти через все три стадии развития этого состояния. Ясно также, что скорость перехода от компенсации к декомпенсации и необратимости зависит от исходного состояния больного, объема кровопотери и, наконец, от интенсивности кровотечения. Не каждое из них в отдельности, а целостный комплекс условий определяет тяжесть течения геморрагического шока.
Компенсированный геморрагический шок обусловлен большей или меньшей потерей объема крови, которая хорошо компенсируется изменениями сердечно-сосудистой деятельности функционального характера. Сознание больного обычно сохранено, он может быть спокойным или несколько возбужденным. Кожные покровы бледны, конечности холодны. Обращают на себя внимание запустевшие подкожные вены на руках, которые становятся нитевидными. Пульс слабого наполнения. Артериальное давление, несмотря на сниженный сердечный выброс, остается на прежнем уровне и в отдельных случаях даже повышается.
Важным симптомом шока является олигурия. Количество выделяемой мочи снижается наполовину или более. В связи с уменьшением венозного возврата ЦВД снижается.
Декомпенсированный обратимый шок характеризуется дальнейшим углублением расстройств кровообращения, при которых спазм периферических сосудов и, следовательно, высокое периферическое сопротивление не в состоянии компенсировать малый сердечный выброс и начинается снижение системного артериального давления. Таким образом, в клинической картине, характеризующейся всеми признаками компенсированной стадии шока - бледностью, тахикардией, гиповолемией и олигурией, на первый план выступает гипотензия как кардинальный симптом, свидетельствующий о расстройстве компенсаторной централизации кровообращения. Следует подчеркнуть, что нарушения органного кровообращения (мозга, сердца, печени, почек, кишечника) начинаются главным образом в этой стадии. В клинической картине декомпенсированного обратимого шока появляются такие симптомы, как акроцианоз, выраженная одышка, усиливаются похолодание конечностей, тахикардия. Тоны сердца становятся глухими, что свидетельствует не только о недостаточном диастолическом наполнении камер сердца, главным образом левого желудочка, но и об ухудшении сократимости миокарда.
Если в I стадии ацидоз носит локальный характер и может не проявляться при исследовании обычной капиллярной крови, то во П стадии ацидоз становится явным и требует коррекции. Как правило, он является отражением углубляющейся тканевой гипоксии.
Дата добавления: 2014-12-27; просмотров: 1540;
