ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ.
Обратимыми в химической кинетике называют такие реакции, которые одновременно и независимо протекают в двух направлениях - прямом и обратном, но с различными скоростями. Для обратимых реакций характерно, что через некоторое время после их начала скорости прямой и обратной реакций становятся равными и наступает состояние химического равновесия.
Все химические реакции обратимы, но при определенных условиях некоторые из них могут протекать только в одном направлении до практически полного исчезновения исходных продуктов. Такие реакции называют необратимыми. Обычно необратимыми бывают реакции, в которых хотя бы один продукт реакции выводится из области реакции (в случае реакции в растворах - выпадает в осадок или выделяется в виде газа), или реакции, которые сопровождаются большим положительным тепловым эффектом. В случае ионных реакций, реакция является практически необратимой, если в результате нее образуется очень малорастворимое или малодиссоциированное вещество.
Рассмотренное здесь понятие обратимости реакции не совпадает с понятием термодинамической обратимости. Обратимая в кинетическом смысле реакция в термодинамическом смысле может протекать необратимо. Для того чтобы реакцию можно было назвать обратимой в термодинамическом смысле, скорость прямого процесса должна бесконечно мало отличаться от скорости обратного процесса и, следовательно, процесс в целом должен протекать бесконечно медленно.
В идеальных газовых смесях и в идеальных жидких растворах скорости простых (одностадийных) реакций подчиняются закону действующих масс. Скорость химической реакции (1.1) описывается уравнением (1.2), а в случае прямой реакции может быть, представлено в виде:
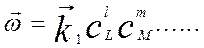 (1.4)
(1.4)
где 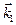 - константа скорости прямой реакции.
- константа скорости прямой реакции.
Подобно этому, скорость обратной реакции:
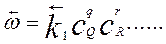 (1.5)
(1.5)
При равновесии 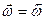 , следовательно:
, следовательно:
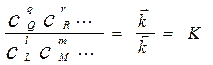
 (1.6)
(1.6)
Это уравнение выражает закон действующих масс для химического равновесия в идеальных системах; К - к о н с т а н т а р а в н о в е с и я.
Константа реакции позволяет найти равновесный состав реакционной смеси при данных условиях.
Закон действующих масс для скоростей реакций можно пояснить следующим образом.
Чтобы произошел акт реакции, необходимо столкновение молекул исходных веществ, т.е. молекулы должны сблизиться друг с другом на расстояние порядка атомных размеров. Вероятность найти в некотором малом объеме в данный момент l молекул вещества L , m молекул вещества M и т.д. пропорциональна 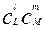 ..... , следовательно, число столкновений в единице объема за единицу времени пропорционально этой величине; отсюда вытекает уравнение (1.4).
..... , следовательно, число столкновений в единице объема за единицу времени пропорционально этой величине; отсюда вытекает уравнение (1.4).
Известны случаи, когда каждое столкновение приводит к реакции. В других случаях, лишь малая доля столкновений приводит к реакции, потому что реагировать способны лишь молекулы с энергией много большей, чем средняя энергия при данной температуре. Это не влияет на применимость уравнения (1.4), т.к. число столкновений, приводящих к реакции, пропорционально общему числу столкновений.
Дата добавления: 2014-12-26; просмотров: 2157;
