СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Пусть протекает реакция, уравнение которой в общем, виде можно записать следующим образом:
 lL + mM + .....= qQ + rR +.... (1.1)
lL + mM + .....= qQ + rR +.... (1.1)
где l; m и q; r - стехиометрические коэффициенты исходных и конечных веществ; L; M и Q; R - исходные и конечные вещества.
Под скоростью химической реакции подразумевается какое количество молекул данного вида реагирует в единицу времени.
Скорости различных реакций можно сравнивать, если относить скорость реакции к единице объема. Поэтому скорость реакции определяют числом молекул или молей данного вещества, реагирующих в единицу времени в единице объема.
Для определения скорости химической реакции достаточно знать изменение во времени количество только одного из веществ - участников реакции (исходного или конечного), так как изменение количества всех остальных веществ можно найти на основании стехиометрии из уравнения (1.1).
По скорости, гетерогенные реакции можно разделить на следующие категории:
1. Реакции с постоянной скоростью. Это имеет место лишь в особом случае гетерогенной реакции между твердым веществом и жидкостью при условии, что а) концентрация реагента постоянна; б) поверхность твердого вещества не изменяется в течение процесса.
2. Реакции, скорость которых уменьшается со временем. Это может происходить за счет: а) снижения концентрации одного из реагентов; б) уменьшения площади поверхности одного из реагентов; в) образования защитной пленки продуктов реакции на поверхности твердого реагента.
3. Реакции со скоростью, увеличивающейся с течением времени. Такие процессы называют автокаталитическими; продукт реакции в последствие реагирует с исходным веществом.
Скорости изменяются от бесконечно малых до бесконечно больших. Поэтому очевидно, что необходимо знание факторов, воздействующих на протекание реакции до конца за минимальное время. Следует учитывать следующие четыре параметра:
1. Влияние концентрации реагентов. Если одним из реагентов является газ, то необходимо знать влияние давления, чтобы эффективно использовать сосуды высокого давления.
2. Влияние температуры. Некоторые гетерогенные реакции значительно ускоряются с повышением температуры.
3. Влияние перемешивания или скорости потока газа.
4. Влияние размеров частиц.
Еще в самом начале исследований химической кинетики было сделано предположение, что реагируют только те молекулы, которые сталкиваются. Как известно, число столкновений прямо пропорционально числу молекул, поэтому скорость реакции должна быть пропорциональна концентрациям реагирующих веществ, т.е. в общем, случае
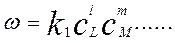 (1.2)
(1.2)
где w - скорость химической реакции; k1 - константа скорости химической реакции ; cL и cM - концентрации реагирующих веществ; l и m - стехиометрические коэффициенты веществ.
Полученное выражение иногда называют основным постулатом химической кинетики.
Физический смысл k1 можно найти, если принять, что все концентрации равны единице, т.е. cL = cM = ...... = 1.
При этом условии
w = k1 (1.3)
Таким образом, константа скорости химической реакции есть скорость этой реакции при условии, что концентрации реагирующих веществ постоянны и равны единице. Константу скорости иногда называютудельной скоростью химической реакции.
Из выражения (2) следует, что скорость реакции является функцией времени, так как с течением времени изменяются концентрации реагирующих веществ.
Дата добавления: 2014-12-26; просмотров: 888;
