КИНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции разделяют или по признаку молекулярности или по признаку порядка.
Молекулярность – определяется числом молекул, одновременно участвующих в химическом акте. Если превращение испытывает одна молекула, то реакция называется мономолекулярной, если в процессе участвуют две молекулы - бимолекулярной и т.д. Так как вероятность одновременного столкновения большого числа частиц мала, молекулярность одностадийного процесса не превышает трех. Тримолекулярные реакции встречаются редко. Реакций более высокой молекулярности практически неизвестно. Если реакция показывает, что в процессе участвует большее число молекул, следовательно процесс идет более сложным путем – через несколько стадий последовательно протекающих реакций, в каждой из которых участвует 2 молекулы, редко 3. Это сложные реакции и их рассматривают как совокупность последовательных или параллельных реакций.
Мономолекулярные реакции – реакции разложения молекул и внутримолекулярных перегруппировок.
F2 = 2F и 2F = F2
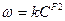
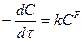 (11 и 12)
(11 и 12)
здесь CF – концентрация исходного вещества. K – имеет размерность [t-1],с1.
Бимолекулярная реакция H2 + F2 = 2HF
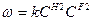
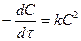 при СH2=CF2=1 Размерность K [k]=t-1c-1 (13 и 14)
при СH2=CF2=1 Размерность K [k]=t-1c-1 (13 и 14)
[C]= моль/л, [k] = 1/моль с/л = л/мольс
Тримолекулярная реакция А + В + С = АВС
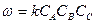 при CA= CB = CC = C
при CA= CB = CC = C 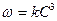
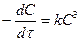 (15,16 и 17)
(15,16 и 17)
Размерность [k] = 1/[t][C2] = t-1C-2 ; C = моль/см3 ; [k] = см6/смоль2
Дата добавления: 2014-12-26; просмотров: 1359;
