Гомогенные реакции
К ним относятся мономолекулярные реакции, например реакции разложения молекул и реакции внутримолекулярных перегруппировок.
F2 = 2F
Те же кинетические уравнения применимы к процессам радиоактивного распада. 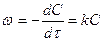 (18)
(18)
Чтобы получить зависимость концентрации от времени, следует проинтегрировать это уравнение, разделив переменные и взяв в качестве пределов C = C0 при t = 0 и при t = t:
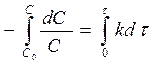 (19)
(19)
Отсюда 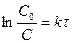 или
или 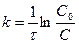 . (20 и 21)
. (20 и 21)
Отсюда  . (22)
. (22)
Из уравнения (21) следует, что константа скорости реакции первого порядка имеет размерность [t-1] и, следовательно, ее численное значение не зависит от единиц, которыми измеряется концентрация.
Как следует из уравнения (22), концентрация экспоненциально уменьшается со временем, прошедшим с начала реакции (кривая 2 на рис.1).
Уравнение (20) может быть представлено в виде :
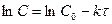 (23)
(23)
Таким образом, в реакциях первого порядка логарифм концентрации находится в линейной зависимости от времени (прямая на рисунке).
| 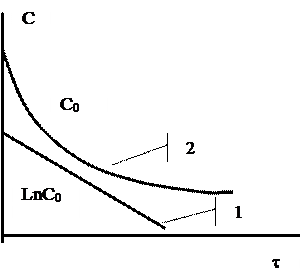 | |||
Если опытные данные укладываются на прямую линию в координатах lnC - t в широком интервале концентраций, то это может служить доказательством того, что рассматриваемая реакция идет по первому порядку.
Часто уравнение (20) используют в несколько иной форме; при этом вводят концентрацию x образовавшегося к моменту t продукта реакции и обозначают через a начальную концентрацию C0. В этом случае
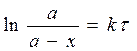 (24)
(24)
Для характеристики реакции часто вместе с величиной константы скорости пользуются величиной времени полупревращения t1/2, т.е. времени в течение которого претерпевает превращение половина исходного вещества. Очевидно, для реакций первого порядка
 (25)
(25)
не зависит от исходной концентрации. Отсюда вытекает следующее уравнение
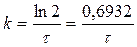 (26)
(26)
Эти соотношения показывают, что k реакции 1-го порядка обратно пропорциональна периоду полураспада. (Используется для процессов р.а. распада).
Дата добавления: 2014-12-26; просмотров: 828;
