Реакции второго порядка. Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид
Для реакций второго порядка, если реагенты имеют одинаковые концентрации, кинетическое уравнение имеет вид
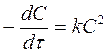 (27)
(27)
После разделения переменных и интегрирования получим
 (28)
(28)
и
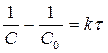 (29)
(29)
Отсюда следует, что для реакции второго порядка должна соблюдаться прямолинейная зависимость между величиной 1/С и временем, а так же, что время полураспада зависит от начальной концентрации:
 (30)
(30)
Итак основная задача определить k, но прежде чем использовать любое уравнение необходимо убедиться, что данная реакция имеет именно тот порядок, которому соответствует это уравнение. Поэтому первейшая задача определить порядок реакции.
Размерность k:
Поскольку размерность скорости не зависимо от порядка реакции есть [C][t-1], то размерность k для реакций 1-го порядка [t-1]; для реакций 2-го порядка – [C-1][t-1] и для реакций 3-го порядка – [C-2][t-1].
Концентрацию С в химической кинетики принято выражать либо в молекулах в 1см3 , либо в молях на литр. Соответственно этому: k 1-го порядка – сек-1; k 2-го порядка – см3/с или л/моль с; k 3-го порядка – см6/с или см3/моль2с.
Дата добавления: 2014-12-26; просмотров: 869;
