ЭНЕРГИЯ АКТИВАЦИИ
В 1884г. Вант-Гофф установил из равенства 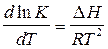 , что lnk должен быть линейной функцией от 1/Т. Это основано на том, что реакцию (1) можно рассматривать состоящей из двух уравнений: для прямой и обратной реакций, протекающих в равновесной системе. Результирующее уравнение имеет вид:
, что lnk должен быть линейной функцией от 1/Т. Это основано на том, что реакцию (1) можно рассматривать состоящей из двух уравнений: для прямой и обратной реакций, протекающих в равновесной системе. Результирующее уравнение имеет вид:
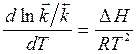 ,
, 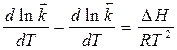 (31)
(31)
Если принять, что  и I- некая константа, то:
и I- некая константа, то:
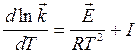 ,
, 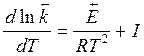 (32)
(32)
Если константа I = 0, то после интегрирования получим уравнение:
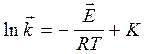 ,
, 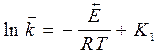 (33 и 34)
(33 и 34)
или
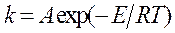 , (35)
, (35)
где  K, K1 - константы интегрирования; А - постоянная величина.
K, K1 - константы интегрирования; А - постоянная величина.
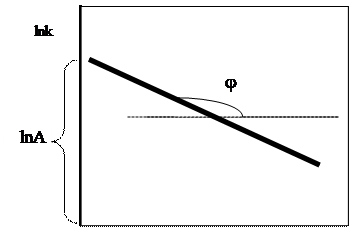
В 1889г. Аррениус определил, что почти для всех реакций графики зависимости lnk от 1/T представляют собой прямые линии (см. Рис. 2). Впоследствии было выведено уравнение:
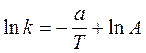 ,
, 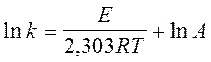 (36 и 37)
(36 и 37)
где tgj = - A/R
При сравнении уравнений (35) и (36) очевидно, что E/RT=2,303a. Аррениус считал, что Е представляет собой разность энергий исходных реагентов и реагентов в активированном виде. Он предполагал также, что I=0, так как это соответствовало результатам его обработки для большинства известных тогда реакций. В 1909г. Величина Е была названа Траутцем энергией активации. Она является характеристикой реакции и определяет влияние температуры на скорость реакции. Из уравнения (35) видно, что константами характеризующими реакцию, являются предэкспонициальный множитель А и энергия активации Е. Когда реакцию проводят при двух различных температурах Т1 и Т2 , то уравнение (35) можно записать в следующем виде: 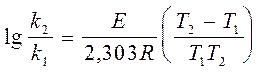 (38)
(38)
 | |||
|
Рис.2. График (зависимость) Аррениуса.
Параметр Е в случае простых реакций, протекающих в одну стадию показывает какой минимальной энергией, в расчете на 1 моль, должны обладать реагирующие молекулы, чтобы они могли вступить в реакцию.
В случае сложных реакций или реакций протекающих в несколько стадий Е не имеет строгого физического смысла и является некоторой функцией энергии активации отдельных стадий, обычно называемой эмпирической (кажущейся) энергией активации.
Никакой особой формы энергии, отвечающей энергии активации в молекулах нет. Энергия активации это то избыточное количество энергии (по сравнению со средней величиной), которой должна обладать молекула в момент столкновения, чтобы быть способной к химическому взаимодействию.
Избыточная энергия может быть:
1. Повышенная кинетическая энергия вращательного или поступательного движения.
2. Повышенная энергия взаимного колебания атомов или атомных групп в молекулах.
3. Повышенная энергия движения электронов.
Так, например, повышенная энергия движения электронов может достигаться при поглощении света (или от воздействия электромагнитных полей). Энергия электронов в атомах может повышаться при разрыве валентной связи (диссоциации, образование свободных радикалов или других атомов с ненасыщенной валентностью, при ударе молекул о стеку сосуда, электроразряд, ультразвук, излучения и т.д.). Обычно при рассмотрении вопросов химической кинетики приходиться иметь дело с системами, в которых доля активных молекул N*/N = 10-10 – 10-20. Если меньше – скорость реакции чрезвычайно мала, если больше – реакция протекает со взрывом.
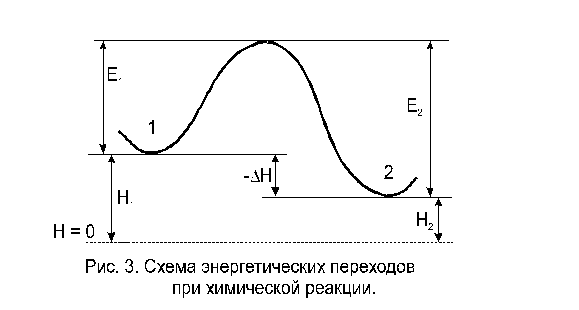
Интересно рассмотреть связь энергии активации с тепловым эффектом реакции. Химическую реакцию, протекающую при p = const, можно представить как переход системы из энергетического состояния 1 в состояние 2 с теплотой DH. На рис. 3 видно, что переход системы из энергетического состояния 1 в состояние 2 возможен при затрате энергии Е1, а обратный переход - при затрате энергии Е2. При осуществлении реакции в прямом направлении выделяется энергия
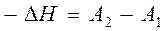 (39)
(39)
Величина -DH равна разности энтальпий исходных и конечных продуктов реакции 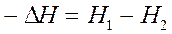 (40)
(40)
отсчитываемых от некоторого уровня, принятого за нулевой Н= 0.
Методы определения энергии активации:
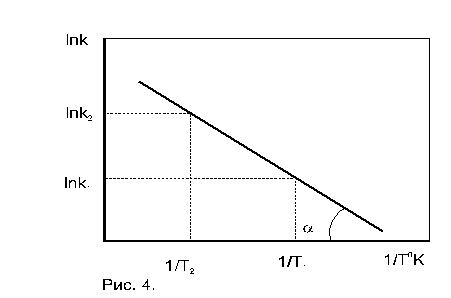
1. По экспериментальным значениям константы скорости реакции: Графический метод (рис. 4):
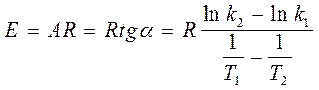 (41)
(41)
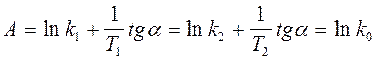 (42)
(42)
где k0 = k при Т =  (экстраполяция).
(экстраполяция).

Аналитический метод:
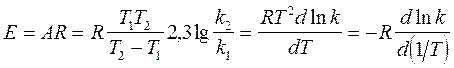 (43)
(43)
Относительный температурный коэффициент константы скорости реакции:
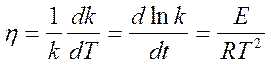 (44)
(44)
Коэффициент h зависит от температуры и поэтому пригоден лишь для сравнительной оценки и ориентировочных расчетов в небольших интервалах температур.
Было сделано много попыток рассчитать теоретически энергию активации. Выдвинуты две основные теории: теория соударений и теория активированного комплекса.
Дата добавления: 2014-12-26; просмотров: 3731;
