Реакции боковой цепи
В аренах в качестве боковых цепей выступают остатки предельных или непредельных углеводородов. Понятно, что в некоторых случаях арены могут участвовать в химических реакциях за счет своих боковых цепей. При этом алкильные заместители придадут арену способность реагировать как алканы, для которых наиболее характерными реакциями являются реакции свободно-радикального замещения. Если в боковой цепи арена находится алкенильная группа, то для него становятся возможными реакции электрофильного присоединения. Бензольное кольцо, сохраняющееся в ходе этих реакций, влияет на скорость и направление соответствующих превращений.
Некоторые из реакций с участием боковой цепи уже рассматривались. Это реакции свободно-радикального хлорирования, восстановления жирно-ароматических кетонов и дегидрирование алкилбензолов. Расширим круг этих реакций новыми примерами.
Окисление аренов. Само бензольное кольцо отличается необыкновенной устойчивостью к действию окислителей. В этом проявляется так называемый ароматический характер. Обычные окислительные реагенты: CrO3, KMnO4, H2O2, OsO4, которые применяются при окислении алкенов, окислить бензол не могут. Конечно, в очень жестких условиях можно окислить и бензольное кольцо. Для этого требуется 450-5000C и наличие катализатора – пятиокиси ванадия. При окислении бензола кислородом воздуха в указанных условиях бензольное кольцо разрушается и получается малеиновый ангидрид
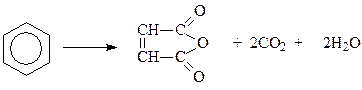
Возможно, это один из лучших технических способов получения малеинового ангидрида.
Все сказанное относительно устойчивости к действию окислителей касается самого бензольного кольца, но не боковых цепей в аренах. Алкильные боковые заместители, в отличие от самих алканов, способны окисляться даже перманганатом калия в водном растворе щелочи.
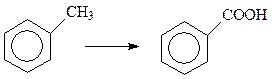
Толуол окисляется уже при 950C количественным выходом в бензойную кислоту.
Интересно отметить, что при окислении аренов действие окислителя всегда направлено на ближайший к бензольному кольцу атом углерода боковой цепи. Поэтому алкилбензолы независимо от длины боковой цепи окисляются в бензойную кислоту
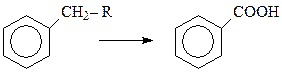
В то же время если этот углерод является четвертичным и не содержит водородного атома, то такой арен в обычных условиях окисления боковой цепи не способен окисляться
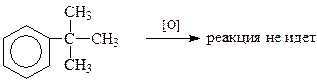
Если бензольное кольцо содержит несколько алкильных групп, то подбором окислителя и условий проведения реакции можно выборочно окислить только один из алкилов. Например, горячей азотной кислотой можно окислить только один из метилов в о-ксилоле
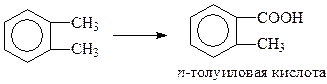
или изопропильную группу в п-цимоле
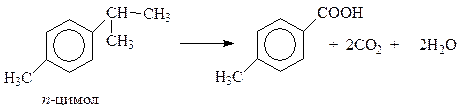

Окисление алкилбензолов широко используется для получения терефталевой кислоты из п-ксилола (мировое производство около 5 млн. т). Окисление ведут кислородом воздуха в присутствии солей кобальта
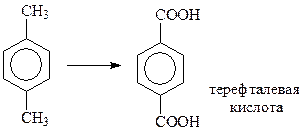
При окислении 1,2,4,5-тетраметилбензола (дурола) образуется весьма ценная четырехосновная ароматическая кислота (пиромеллитовая кислота), которая используется при получении полиэфиров
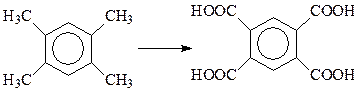
11.5.9. Реакции присоединения к алкенилбензолам. В молекуле алкенилбензолов имеется бензольное кольцо и в качестве боковой цепи – остаток непредельного углеводорода. Эти две функциональные группы относительно друг друга могут занимать различное положение. В том случае, если двойная связь далека от кольца, то эти структурные единицы будут слабо влиять на реакционную способность друг друга. Наиболее интересным представляется случай, когда кольцо и двойная связь сопряжены. При этом бензольное кольцо в наибольшей степени будет влиять на скорость и направление реакции электрофильного и радикального присоединения к кратной связи.
Рассмотрим гидробромирование 1-фенилпропена. В результате этой реакции получается 1-бром-1-фенилпропан (в отсутствии перекисей) или 2-бром-1-фенилпропан (в присутствии перекисей)
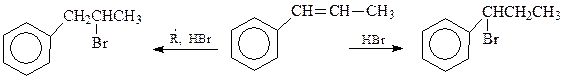
Понятно, что в случае проведения реакции в присутствии перекисей она протекает с промежуточным образованием радикалов
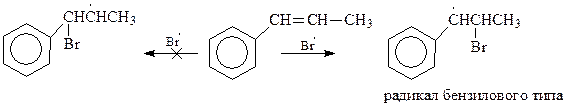
Ранее уже обсуждалось, что бензиловый радикал, а также радикалы бензилового типа, относятся к наиболее устойчивым радикалам. Поэтому нет ничего удивительного в том, что гомолитическое присоединение протекает через наиболее устойчивый радикал с образованием 2-бром-1-фенилпропана
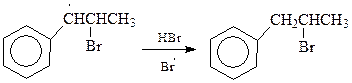
Ионное присоединение также протекает с промежуточным образованием наиболее стабильного карбокатиона бензилового типа. Подсчитаем расход энергии при получении бензилового карбокатиона из толуола. Эта энергия будет складываться из энергии диссоциации толуола (326,59 кДж) и энергии ионизации бензилового радикала (749,47 кДж). Отсюда видно, что для получения бензилового карбокатиона надо затратить 1076,06 кДж. Для сравнения: для метильного карбокатиона – 1390,08 кДж, для трет-бутильного карбокатиона – 1096,99 кДж. Сравнение вышеприведенных величин показывает, что бензильный карбокатион должен обладать почти такой стабильностью, что и трет-бутильный карбокатион. Считается, что устойчивость рассматриваемого карбокатиона связана с его резонансной стабилизацией с участием бензольного ядра. Другими словами, положительный заряд бензилового иона рассредоточен с участием бензола настолько эффективно, что этот ион относится к числу наиболее устойчивых. Вспомним правило - то, что устойчиво, легче образуется. Поэтому реакция ионного гидробромирования пропенилбензола протекает с промежуточным образованием катиона бензилового типа с получением 1-бром-1-фенилпропана
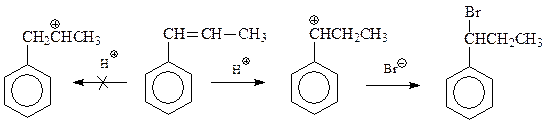
Рассматривая реакции алкенилбензолов, в которых двойная связь сопряжена с бензольным ядром, отметим, что подобные соединения легко полимеризуются. Общеизвестный пример – стирол, который в присутствии следов инициатора – перекиси бензоила, полимеризуется в полистирол
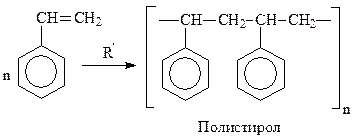
Дата добавления: 2014-12-24; просмотров: 7486;
