Закономерности реакций электрофильного замещения
Реакции электрофильного замещения составляют существенную часть химии ароматических соединений. Примеры таких реакций были рассмотрены раньше. Теперь наступила пора попытаться объяснить феноменологические наблюдения над реакциями, выявить общие закономерности их протекания, предложить и обосновать механизм электрофильного замещения в ароматическом ряду и на этой основе рассмотреть влияние замесителей в кольце на ориентацию и реакционную способность.
11.5.10.1. Правила замещения. Исторически сложилось так, что первоначальные обобщения над реакциями замещения были сформулированы в виде свода правил (Голлеман). Эти правила ничего не объясняли, однако позволяли бездумно предсказывать направление замещения и продукты реакции. С тех пор теоретическая органическая химия шагнула далеко вперед, однако представляется, что правила замещения не потеряли своего значения и в наши дни именно в силу своей непритязательности и предсказательных возможностей.
Обобщение большого числа реакций замещения в ароматическом ряду показало, что имеющийся в бензольном кольце заместитель влияет как на реакционную способность соединения, так и на место вступления нового заместителя в кольцо. Оказалось, что одни заместители способствуют реакции и направляют новый заместитель в о- и п-положение по отношению к имеющемуся заместителю. Они были названы заместителями 1 рода, о- и п-ориентантами и электронодонорными заместителями. Вот они:
-NH2, -NHR, -NR2, -OH, -NHCOR, -OR, -C6H5, , алкилы, галогены
Другая группа заместителей затрудняет ход реакции, а новые заместители направляют в м-положение. Эти заместители были названы заместителями 2 рода, м-ориентантами, электроноакцепторными заместителями
-CN, -CHO, --COR, -COOH, -COOR, -SO3H, -NR3 ,-CF3, -CCl3, -NO2
В ароматическом кольце может быть и несколько заместителей. Как же в таком случае формулируются правила замещения?
В дизамещенных бензолах влияние заместителей может быть согласованным или несогласованным. Следующие ароматические соединения будут вступать в реакции замещения, испытывая согласованное влияние заместителей
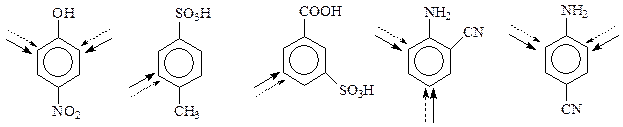
Вот примеры структур с несогласованным влиянием заместителей
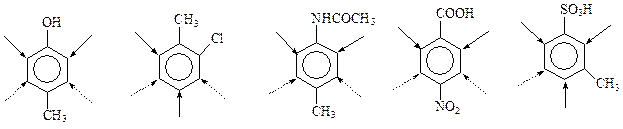
При участии в реакции таких соединений возможны следующие варианты:
1. Если кольцо содержит два электронодонорных заместителя, то реакция идет под ориентирующим влиянием более сильного из них.
2. Если в кольце находятся заместители 1 и 2 рода, то замещение протекает под ориентирующим влиянием первого из них.
3. По стерическим соображениям новый заместитель обычно не вступает в кольцо между заместителями, находящимися в м-положении.
Выше отмечалось, что в случае ди- или более замещенных бензолов реакции замещения протекают под активирующим и ориентирующим влиянием более «сильного» заместителя. Установлено, что заместители 1 рода по убыванию активирующей и ориентирующей силы располагаются в следующий ряд
-NH2> –OH> -OCH3> -NHCOCH3 > -C6H5> -CH3> м-ориентанты
В случае дизамещенных бензола, чем больше заместители различаются по силе, тем точнее соблюдаются правила замещения и тем выше их предсказательная сила. В противном случае результат реакции весьма неопределенен. Так, при нитровании п-хлортолуола, в котором метильная группа и хлор обладают близким ориентирующим эффектом, получаются оба возможных продукта с сопоставимыми выходами
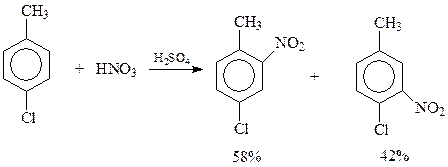
При проведении реакций замещения с участием монозамещенных бензолов возникает вопрос о соотношении продуктов замещения в о- и п-положения. У монозамещенных бензолов одно п-положение и два о-положения. Поэтому статистически соотношение продуктов должно быть 2:1 или близко к этому. В действительности бывает и наоборот. Так, при нитровании бромбензола о-изомер получается с выходом в 38%, а п-изомера образуется 62%
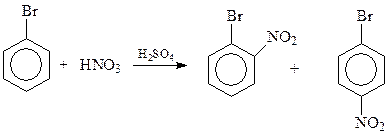
Считается, что предсказанные статистикой соотношения не соблюдаются из-за пространственных факторов. Из-за них вновь вступающие в кольцо заместители стремятся расположиться как можно дальше от имеющегося заместителя.
В связи с обсуждением закономерностей реакций замещения на эмпирическом уровне отметим еще, что иногда результаты реакции становятся неожиданными из-за трансформации заместителей. Примером может послужить сульфирование анилина. Казалось бы, это соединение, содержащее один из наиболее сильных заместителей 1 рода, должно легко сульфироваться с образованием смеси о- и п-изомеров. Однако это не так, реакция идет с трудом с образованием м-изомера. Происходит это потому, что анилин, являющийся основанием, протонируется кислотой. При этом аминогруппа, являющаяся активирующим заместителем, превращается в ион аммония, который относится к дезактивирующим заместителям. Дальше реакция идет уже под контролем иона аммония
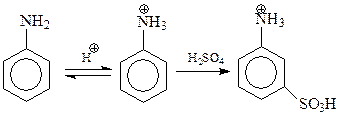
Интересно отметить, что иногда направление замещения можно изменить варьированием условий проведения реакции. Так, метилирование толуола хлористым метилом в присутствии AlCl3 при 0оC приводит к смеси о- и п-ксилолов. При проведении реакции при 80оC основным продуктом реакции становится м-ксилол
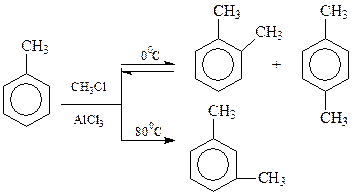
Следует отметить, что рассмотренные в данном разделе эмпирические закономерности не носят абсолютного характера. Они предсказывают лишь основное направление реакции. Так, бромирование толуола в соответствии с правилами замещения дает ожидаемую смесь о-бромтолуола (33%) и п-бромтолуола (67%). В то же время при сульфировании толуола наряду с ожидаемыми толуолсульфокислотами получается также и м-изомер (6%).
Дата добавления: 2014-12-24; просмотров: 3986;
