Общий механизм электрофильного замещения
Согласно устоявшимся воззрениям, электрофильное замещение в ароматическом ряду протекает в две элементарные стадии. На первой стадии богатое электронами бензольное ядро подвергается атаке электрофильной частицей – катионом или положительно заряженным концом сильно поляризованного комплекса катализатора с реагентом. При этом возникает ковалентная связь между электрофилом и одним из углеродов бензольного кольца за счет двух из шести его π-электронов
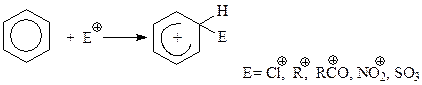
Следует внимательно рассмотреть структуру той частицы, которая при этом получается. В научной литературе ее называют σ-комплексом или же бензониевым карбокатионом. Этот ион:
- не обладает ароматичностью, у него только 4 электрона. По сравнению с бензолом, из которого он образовался, σ-комплекс менее устойчив на величину энергии резонанса (150,73 кДж);
- один из углеродов бензольного кольца – тот, который образовал связь с электрофилом, претерпел перегибридизацию из sp2 в sp3;
- единое электронное поле из 6 π-электронов бензольного кольца распалось, теперь 2 электрона из их числа обеспечивают персональную связь одного из углеродов кольца с электрофилом. Оставшиеся 4 электрона приходятся на 5 sp2-гибридизованных углерода кольца, поэтому σ-комплекс несет положительный заряд. Однако этот заряд не сосредоточен на каком-то конкретно углероде кольца, а делокализован между всеми пятью углеродами, хотя и не в равной мере.
Полагают, что бензониевый ион представляет собой резонансный гибрид нескольких канонических структур. Для написания их формул прибегнем к следующему приему. Изобразим бензольное кольцо в виде одной из структур Кекуле. Тогда образование σ-комплекса можно передать следующей схемой
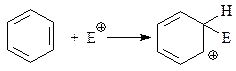
При изображении бензониевого иона в таком виде сразу видно, что ему можно придать и другие альтернативные структуры, рассматривая ион как «супераллил–катион»
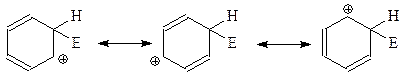
Таким образом, бензониевый катион можно представить как резонансный гибрид трех предельных структур

Следует обратить внимание на тот факт, что присоединение электрофила к бензолу в точности повторяет присоединение электрофила к двойной связи алкена. Разница только в том, что в данном случае получается карбокатион (σ-комплекс) существенно более сложного строения.
Перед σ-комплексом два пути. Он может, как и во второй стадии реакции электрофильного присоединения к алкенам, присоединить подходящий нуклеофил и дать конечный продукт реакции. Другой путь – отщепление каким-нибудь нуклеофилом протона у σ-комплекса. После ухода протона ковалентная пара электронов, обеспечивавшая его связь с углеродом, освобождается и может включиться в ароматический секстет. Это означает возрождение ароматической системы, которая отличается особой устойчивостью
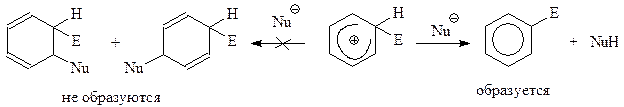
Итак, электрофильное замещение в ароматическом ядре - процесс двухстадийный. На первой стадии происходит медленное образование карбокатиона, который на второй стадии быстро отщепляет протон и дает продукт реакции. Этот общий механизм реакции электрофильного замещения хорошо согласуется с экспериментальными фактами, на его основе легко объясняются реакционная способность и ориентация. Тем не менее, пока еще предложенный механизм ничем не доказан. В частности, это касается двухстадийного характера реакции и отнесения первой стадии к лимитирующей, определяющей скорость процесса в целом.
Для подтверждения предложенного механизма был использовано явление изотопного эффекта, которое заключается в следующем.
В реакции, протекающей с разрывом связи углерод – водород, водород может быть представлен своими изотопами: протием, дейтерием или тритием, которые существенно различаются по массам
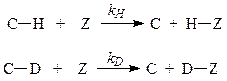
Встает вопрос, в какой мере замена одного изотопа другим скажется на скорости реакции? Очевидно, что здесь имеется два варианта: в одном случае реакция эту замену почувствует, а в другом – нет. Если при замене одного изотопа на другой скорость реакции изменяется, то говорят о наличии изотопного эффекта, в противном случае – о его отсутствии. Установлено, что в большинстве реакций, протекающих с положительным дейтериевым изотопным эффектом, соотношение констант скоростей kH /kD колеблется в пределах 5-8. Отметим, что при исследовании механизмов реакций значение имеет только наличие или отсутствие изотопного эффекта. Как трактуется факт наличия или отсутствия изотопного эффекта при изучении механизмов реакций?
Любая химическая реакция складывается из ряда элементарных стадий. Скорость химической реакции в целом определяется скоростью наиболее медленной из них. В реакции, протекающей с разрывом связи углерод-водород, наличие или отсутствие изотопного эффекта позволяет однозначно определить момент разрыва рассматриваемой связи. Если в реакции изотопный эффект отсутствует, то это означает, что связь углерод-водород разрываетсяпослелимитирующей стадии, в быстрой стадии, когда подмена одного изотопа другим уже значения не имеет. Если изотопный эффект имеет место, то из этого следует, что связь углерод-водород разрывается на лимитирующей стадии.
Как же обстоит дело в случае реакции электрофильного замещения в ароматическом ряду? В этом случае изотопный эффект отсутствует, за исключением нескольких несущественных отступлений от этого общего правила. Из этого факта следует, что в реакциях электрофильного замещения в ароматическом ряду разрыв связи С-Н происходит на быстрой стадии, которой предшествует медленная стадия образования σ-комплекса.
Интересно, что факт отсутствия изотопного эффекта при ароматическом замещении можно использовать для аргументации еще некоторых особенностей этой реакции.
Не может ли замещение происходит в одну стадию? Нет, не может. В таком случае эта единственная стадия была бы и лимитирующей стадией и для нее наблюдался бы изотопный эффект.
Отсутствие в реакции ароматического замещения изотопного эффекта позволяет судить также о скоростях образования и превращения бензониевого иона. Если бы указанные элементарные стадии протекали с сопоставимыми скоростями, то при электрофильном замещении в ароматическом ряду проявил бы себя изотопный эффект. Отсутствие указанного эффекта свидетельствует о значительном превалировании скорости превращения карбокатиона над скоростью его образования.
Дата добавления: 2014-12-24; просмотров: 1514;
