Влияние заместителей на ориентацию
При изучении классических реакций ароматического замещения можно было видеть, что одни заместители в бензольном кольце новые заместители направляют в о- и п-положения, а другие – в м-положение. Как эти наблюдения согласуются с предложенным механизмом реакции?
Рассмотрим в общем виде реакцию электрофильного замещения (электрофил Е+) участием в ней ароматического соединения, несущего в бензольном кольце заместитель 1 рода, например, ОСН3 .
На лимитирующей стадии реакции возможно образование трех карбокатионов, с различным местом вступления нового заместителя в кольцо
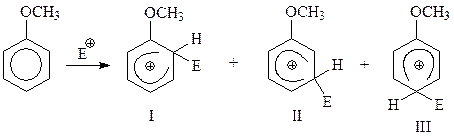
Спрашивается, с образованием какого из этих трех промежуточных частиц пойдет реакция? Ответ на демагогическом уровне достаточно прост. Реакция пойдет с преимущественным образованием того σ-комплекса, который более устойчив. Вся беда заключается в том, что современная квантовая химия не отвечает на этот вопрос. Поэтому суждение о стабильности карбокатионов будем выносить с использованием теории резонанса.
При о-атаке на бензольное кольцо получается карбокатион, который можно представить себе как резонансный гибрид нескольких структур. Для написания этих резонансных структур изобразим бензол в виде структуры Кекуле, после присоединения к которой электрофильного реагента появляется одна из канонических формул. Если в этой формуле переместим двойную связь и положительный заряд как в случае аллильных катионов, то появятся и другие возможные канонические структуры
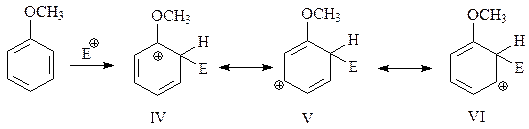
В одной из предельных структур (IV) электронодонорная группа СН3О связана с электронодефицитным углеродом бензольного кольца. Поэтому в этом случае появляется возможность образования дополнительной связи между кислородом метоксигруппы и упомянутым углеродом за счет несвязывающей электронной пары кислорода. Это приводит к появлению еще одной резонансной структуры
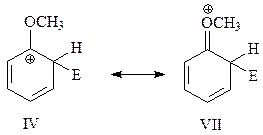
Таким образом, при замещении в о-положение образуется σ-комплекс, который можно представить как резонансный гибрид четырех предельных структур IV – VII
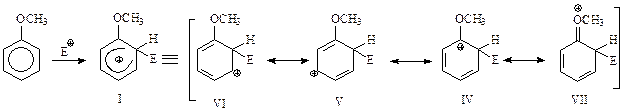
Аналогичным образом можно представить м- и п-замещение
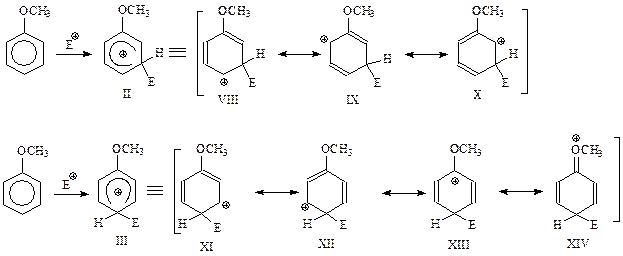
Теперь появляется возможность обсуждения относительной устойчивости σ-комплексов, образующихся при замещении в различные положения бензольного кольца.
В случае о-замещения среди канонических структур фигурирует структура IV, которая особенно устойчива. Это связано с тем, что в этой резонансной структуре электронодонорный заместитель подает электроны не просто к бензольному кольцу, а конкретно - к электронодефицитному углероду этого кольца. Такая же особенно устойчивая предельная структура обнаруживается и при п-замещении (XIII). При м-замещении такого рода устойчивые структуры не встречаются. Таким образом, при электрофильном замещении с участием ароматических соединений с заместителями 1 рода при о- и п-атаке электрофила на лимитирующей стадии получаются относительно устойчивые σ-комплексы I и III. Их устойчивость обусловлена вкладом канонических структур IV и XIII в соответствующие резонансные гибриды. Понятно, что более устойчивые карбокатионы I и III образуются легче и быстрее, чем II, и поэтому реакция идет как о- и п-замещение.
Теперь рассмотрим реакцию электрофильного замещения ароматического соединения, несущего в бензольном кольце заместитель 2 рода. Представим себе, что, как и в предыдущем случае, реакция может пойти как о-, м- или п-замещение. В каждом случае будет получаться свой σ-комплекс, представляющий собой резонансный гибрид нескольких канонических структур
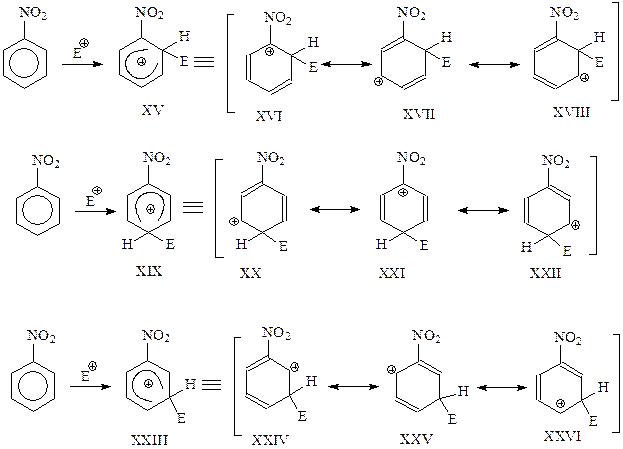
Рассмотрение предельных структур показывает, что XVI и XXI будут менее устойчивыми, чем другие. Дестабилизация в этих случаях связана с тем, что электроноакцепторная NO2-группа оттягивает электроны не вообще от бензола, а именно от электронодефицитного углерода бензольного кольца. Благодаря участию в резонансе этих наименее устойчивых канонических структур, σ-комплексы XV и XIX будут уступать по стабильности карбокатиону XXIII, образующемуся при м-ориентации. По указанной причине реакция электрофильного замещения ароматического соединения с заместителем 2 рода будет протекать как м-замещение.
Дата добавления: 2014-12-24; просмотров: 2180;
