Генерирование электрофильных частиц
Все реакции электрофильного замещения включают стадию образования электрофильной частицы. Образование электрофила обычно связано с какой-нибудь реакцией кислотно–основного равновесия.
При галогенировании галогенид железа или иная кислота Льюиса вызывает ионизацию молекулы галогена. В этом сказывается способность хлорида железа принимать электрон
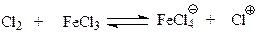
Не исключено, что в действительности дело, может быть, и не доходит до полной ионизации молекулы галогена. Возможно, имеет место просто поляризация с образованием комплекса галогена с катализатором
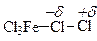
В этом случае роль электрофила выполняет положительно заряженный конец комплекса.
Интересно отметить, что при галогенировании алкенов они способны сами создавать для себя электрофильный атом галогена, без постороннего участия. Происходит это потому что π-электроны двойной связи поляризуют молекулу галогена. Такой способностью π-электроны бензольного кольца не обладают поэтому приходится использовать катализатор.
При нитрованииэлектрофильная частица – ион-нитрония – NO2+, образуется при взаимодействии серной и азотной кислот, смесь которых называется нитрующей смесью
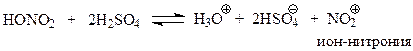
В этом кислотно-основном равновесии серная кислота выступает в роли кислоты, а азотная кислота – основания. То, что при этом получается ион нитрония, принимающий участие в реакции замещения как электрофил, сомнений не вызывает. Нитроний-ион хорошо изучен в виде своих солей: перхлората - (NO2+ClO4-) и тетрафторбората нитрония (NO2+BF4-).
При сульфировании, в отличие от реакций галогенирования и нитрования, в качестве электрофила выступает нейтральная частица – SO3, образующаяся при взаимодействии двух молекул серной кислоты
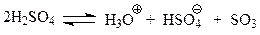
Серный ангидрид, хотя и является электронейтральным, относится к электрофильным частицам. В молекуле ангидрида атом серы окружен лишь шестью электронами. Нарушение правила октетов в молекуле этого соединения делает атом серы электронодефицитным, способным выступать в реакциях замещения в качестве электрофила.
При алкилировании по Фриделю-Крафтсу, независимо от природы применяемого реагента (галогенпроизводные, алкены, спирты), в качестве электрофильной частицы выступают карбокатионы. Пути их образования видны из следующих реакций
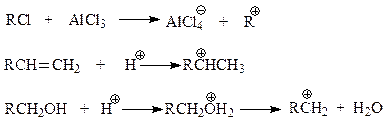
При изучении реакции Фриделя-Крафтса отмечалось, что обычно в результате реакции в бензольном кольце оказывается не тот алкил, который был в галогеналкане. Протекание реакции с участием карбокатионов легко объясняет эту особенность замещения. Во всех реакциях с участием карбокатионов они претерпевают перегруппировки в направлении образования более стабильных из них. Этот более устойчивый катион, образовавшийся из менее устойчивого по типу 1,2-алкильных (гидридных) сдвигов, и оказывается электрофилом в реакции Фриделя-Крафтса.
Рассмотрим такой пример. В реакции алкилирования с участием хлористого пропила и хлористого алюминия первоначально может образоваться только пропильный карбокатион

который дальше атакует бензол или перегруппировывается по механизму 1,2-гидридного сдвига в более устойчивый изопропильный катион
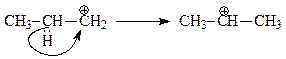
Судя по тому, что продуктом реакции является изопропилбензол, перегруппировка все-таки превалирует над реакцией алкилирования пропильным карбокатионом.
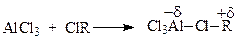
Следует отметить, в реакции Фриделя-Крафтса наряду с карбокатионами могут принимать участие также и другие электрофилы, например, полярные комплексы, образованные галогеналкилом и катализатором
При ацилировании, другой разновидности реакции Фриделя-Крафтса, электрофилами являются ацилий-катионы, образующиеся при взаимодействии ацилгалогенида или ангидрида карбоновой кислоты с катализатором

Дата добавления: 2014-12-24; просмотров: 4074;
