Реакции замещения
11.5.1. Галогенирование. Галогены в зависимости от условий проведения реакции могут реагировать как с ароматическим кольцом, так и с боковой цепью. Каталитическое галогенирование способствует реакции галогена с бензольным кольцом с замещением водородных атомов на галоген. В качестве катализаторов чаще всего используются галогениды металлов, выступающих в качестве акцепторов электронов: FeBr3, AlCl3 и ZnCl2. Роль катализатора сводится к поляризации связи между атомами галогена
Br-δ – Br+δ --- FeBr3
В результате реакции между ареном и галогеном образуется ароматическое галогенпроизводное. Интересно, что реакция может пойти и дальше, причем второй атом занимает в основном р-положение по отношению к первому
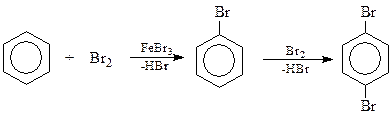
Установлено, что галогены по убыванию реакционной способности в реакции галогенирования аренов располагаются в следующий ряд
F2>Cl2>Br2>I2
Прямое введение атома галогена в ароматическое кольцо практически осуществимо лишь в случае хлора и брома. Фтор в данной реакции слишком активен. Иод, напротив, слишком пассивен. Он переходит в более активную форму (возможно, I+) лишь в присутствии окислителей, например, азотной кислоты
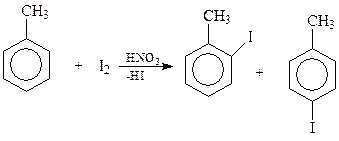
Как и следовало ожидать, под действием ультрафиолетового освещения действие галогена направляется в боковую цепь и реакция сводится к хорошо изученному цепному свободно-радикальному фотохимическому галогенированию. Как и в случае метана, в толуоле последовательно можно заместить на хлор все три водорода метильной группы
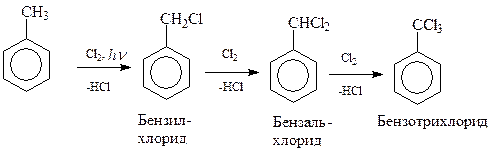
Интересно отметить, что при фотохимическом хлорировании в первую очередь на хлор замещаются водородные атомы ближайшего к бензольному ядру углеродного атома боковой цепи
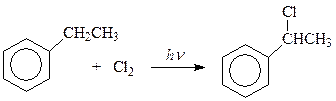
Такое развитие событий связано с образованием в лимитирующей стадии реакции особенно устойчивого радикала бензильного типа
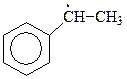
На образование бензильного радикала из толуола требуется лишь 326,59 кДж (для образования трет-бутильного радикала из изобутилена 381,02 кДж, для аллильного радикала 322,40 кДж). Из представленных энергий диссоциаций связей видно, что бензильный радикал содержит меньше энергии и более устойчив, чем даже трет-бутильный радикал. Это объясняет легкость образования бензильного радикала. Устойчивость радикалов бензильного типа связана с участием в делокализации электрона бензольного кольца.
11.5.2. Нитрование. При взаимодействии с азотной кислотой арены замещают свои водородные атомы на нитрогруппу
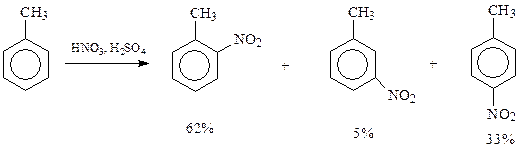
В реакцию нитрования арены вступают легче, чем сам бензол. Благодаря присутствию в толуоле электронодонорной метильной группы удается заместить на нитрогруппу все три способных к замещению водородных атома
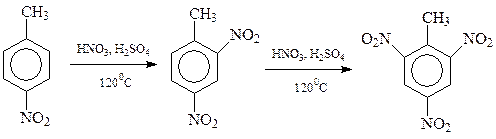
Интересно отметить, что вступившая в кольцо нитрогруппа затрудняет дальнейшее нитрование. Известно, например, что п-нитротолуол в реакции нитрования значительно уступает в реакционной способности толуолу.
При нитровании реакция идет лучше при использовании в качестве нитрующего агента смеси азотной и серной кислот (1:2). Эта смесь называется нитрующей смесью. Установлено, что в нитрующей смеси происходит реакция между кислотами, в результате которой образуется электрофильная частица – ион-нитрония, которая и участвует в нитровании
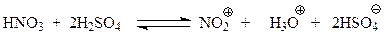
В рассматриваемом кислотно-основном равновесии серная кислота выступает в роли сильной кислоты, а азотная кислота ведет себя как основание. Серная кислота, участвуя в вышеприведенном равновесии, способствует повышению концентрации нитроний-иона в реакционной смеси, что приводит к повышению скорости нитрования. Доказательство роли нитроний-иона при нитровании основано на том, что реакция хорошо идет и с другими источниками этого иона. Так, нитронийфторборат способен быстро нитровать бензол

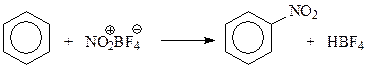
На концентрацию нитроний-иона в нитрующей смеси и на результат нитрования отрицательно влияет вода, которая реагирует с ионом
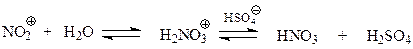
По этой причине при нитровании обычно используются безводные кислоты (дымящие азотная и серная кислоты).
Кроме нитрующей смеси при нитровании могут быть использованы и другие нитрующие агенты. К ним относятся ацетилнитрат, пятиокись азота, бензоилнитрат и др. Ацетилнитрат и бензоилнитрат получают по следующим реакциям
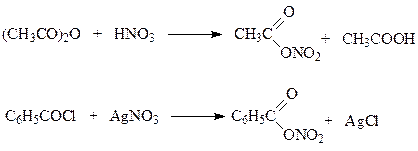
Указанные нитрующие агенты в условиях нитрования генерируют ион-нитрония
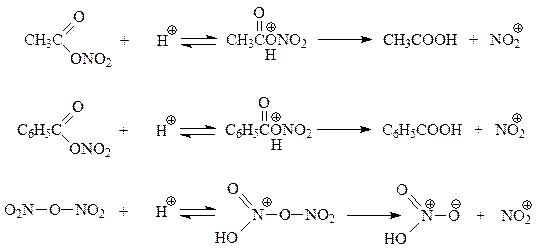
11.5.3. Сульфирование. Уже при комнатной температуре при взаимодействии бензола со 100%-ной серной кислотой происходит реакция сульфирования – введения остатка серной кислоты в бензольное ядро. С трудом, но в бензольное кольцо удается ввести и вторую сульфогруппу, которая занимает м-положение по отношению к первой сульфогруппе
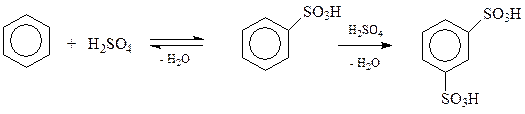
Две сульфогруппы настолько дезактивируют кольцо, что ввести в него третью сульфогруппу уже не удается.
При сульфировании образуется также вода, которая разбавляет серную кислоту. Это приводит к снижению скорости сульфирования. К тому же, рассматриваемая реакция является обратимой. С целью предотвращения разбавления серной кислоты и смещения равновесия реакции вправо, сульфирование проводится с удалением реакционной воды по ходу опыта.
Толуол содержит электронодонорную метильную группу, которая способствует сульфированию. Поэтому толуол сульфируется легче, чем бензол и образует смесь о- и п-толуолсульфокислот
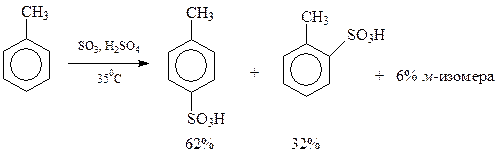
11.5.4. Алкилирование и ацилирование. Алкилирование заключающееся во введении алкильного радикала в бензольное кольцо, уже рассматривалось.
Процесс введения в молекулу органического соединения, в данном случае аренов, кислотного остатка (ацила) называется ацилированием
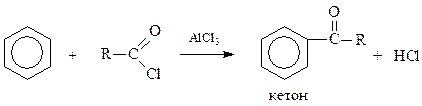
Эта реакция приводит к получению арилзамещенных кетонов.
Поскольку углеводородные остатки активируют бензольное кольцо в реакциях замещения, то все арены достаточно легко вступают в реакцию ацилирования. При этом кислотный остаток занимает о- и п-положение по отношению к алкильному заместителю. Считается, что ароматическое соединение успешно ацилируется, если его реакционная способность не меньше, чем у галогенпроизводных бензола.
Как правило, ацилирование проводится в растворителе, в качестве которого используется сероуглерод, нитробензол или избыток арена.
В качестве ацилирующего агента возможно использование карбоновой кислоты, ее ангидрида или галогенангидрида. Наибольшей активностью обладают галогенацилы, наименьшей – сами кислоты. При ацилировании галогенацилами в качестве катализатора реакции используется хлорид алюминия или другие кислоты Льюиса. В реакции с участием кислот уже требуется использование более сильных катализаторов, например, дымящей серной кислоты.
В ходе реакций алкилирования и ацилирования много общего, они оба относятся к реакции Фриделя-Крафтса. Вместе с тем имеются и различия.
Продуктом ацилирования аренов являются жирно-ароматические кетоны. Оказалось, что они способны образовать комплекс с хлоридом алюминия, который уже не является катализатором
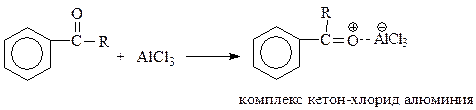
Образование комплекса вызывает ненужное расходование катализатора. К тому же по окончании опыта кетон, являющийся продуктом реакции, приходится выделять разрушением комплекса водой.
Еще одно следствие комплексования кетона с хлоридом алюминия заключается в том, что этот комплекс дезактивирует бензольное кольцо и делает невозможным вхождение в него второй ацильной группы.
Все сказанное остается в силе и при ацилировании в присутствии хлористого алюминия ангидридами кислот. Однако в этом случае ситуация еще более осложняется ввиду того, что и ацилирующий агент комплексуется с молекулой катализатора
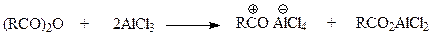
Если образующийся при этом ацилий-катион участвует в реакции, то этого нельзя сказать про комплекс хлористого алюминия с карбоксилатной частью ангидрида. Таким образом, ацилирование арена ангидридом кислоты в присутствии хлористого алюминия протекает таким образом, что один моль хлорида образует комплекс с карбоксилатной частью ангидрида, второй моль дает комплекс с продуктом реакции. В результате в этом случае на моль ацилирующего агента приходится брать более двух молей катализатора.
Дата добавления: 2014-12-24; просмотров: 3875;
