Ароматичность
В связи с существованием у некоторых соединений ароматического характера, обусловленного своеобразием их строения, встает вопрос, какие же особенности строения молекулы ответственны за проявления этих свойств?
Из материала предыдущего раздела понятно, что для этого необходимо, чтобы молекула содержала циклическую систему делокализованных р-электронов. По очевидным соображениям, возникновение единого облака таких электронов возможно только в том случае, если молекула циклическая (только в этом случае возможно появление кольцевой системы) и плоская (иначе нарушится параллельность осей р-электронов). Однако оказывается, что все изложенное выше необходимое, но не достаточное условие для проявления соединением ароматического характера. Определяющим фактором оказалось число р-электронов, образующих циклическую систему. У соединений, обладающих ароматическим характером, их в молекуле должно быть строго определенное число: 2, 6, 10, 14 и т.д. Как установил Э.Хюккель, единое электронное облако у ароматической системы должно насчитывать
(4n + 2)
р-электронов, где n=0, 1, 2, 3, 4 и т.д. Эта формула выведена Хюккелем из соображения заполнения различных орбиталей, образующих р-облако, и более подробно в данной книге не рассматривается.
Итак, если молекула циклическая, плоская и содержит хюккелевское число р-электронов, то она будет обладать ароматическим характером, т.е. проявлять высокую термодинамическую устойчивость и легко вступать в реакции замещения при формальной непредельности. Всем указанным требованиям удовлетворяют бензол (n=1), нафталин (n=2), антрацен и фенантрен (n=3) и другие полициклические ароматические системы
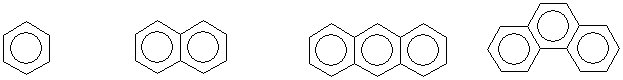
Пока вне поля зрения оставался случай с n=0, т.е. система, состоящая из двух р-электронов. Понятно, что два электрона могут составить «единую циклическую систему делокализованных электронов» не при любом размере кольца. Так, два р-электрона в циклобутановом, циклопентановом или же в циклогексановом кольце составят лишь молекулы циклобутена, циклопентена и циклогексена, не проявляющих ароматического характера
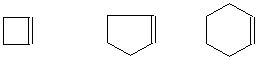
Может быть, ароматическим характером будет обладать молекула циклопропена? Оказывается, тоже нет. В молекуле циклопропена невозможна делокализация электронов. Другое дело случай циклопропенил-катиона, когда такая возможность возникает. Действительно, один из производных иона циклопропения С3Н3+, синтезированный по следующей схеме
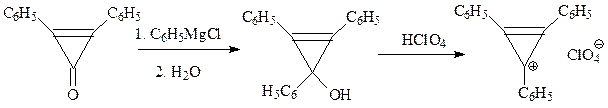
представлял собою достаточно устойчивую при хранении соль (перхлорат), в молекуле которой все углерод-углеродные связи оказались равной длины, а р-электроны сильно делокализованы
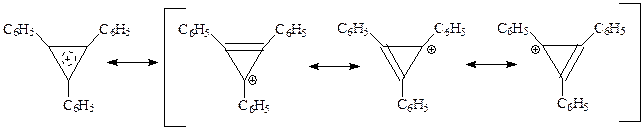
Понятно, что рассматриваемая система обладала ароматическим характером. Следует отметить, что ион циклопропения представляет собой самый маленький цикл, которому присущ ароматический характер. Другая особенность этой системы заключается в том, что ароматический характер проявляет не нейтральная молекула, а ион. В последующем оказалось, что имеются и другие примеры подобного рода.
Циклопентадиен (1) не может быть отнесен к ароматическим системам на том основании, что содержит лишь 4 р-электрона. Это не согласуется с правилом Хюккеля. Однако положение меняется, если молекулу циклопентадиена покинет один из водородов из метиленовой группы, оставив свой электрон. Например, в результате следующей реакции
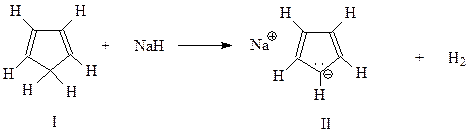
В этом случае возникнет циклопентадиенил-анион II, в котором уже возможно образование замкнутого кольца шести делокализованных р-электронов. В результате циклопентадиенил-анион, в отличие от самого циклопентадиена, должен обладать ароматичностью. Установлено, что этот анион действительно существует в виде дициклопентадиенила железа (ферроцена) III. Ферроцен имеет строение сэндвича, в котором между двумя циклопентадиенил-анионами располагается атом двухвалентного железа
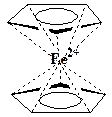
Ферроцен действительно обладает ароматичностью. Все связи между углеродными атомами в циклопентадиенильных анионах выравнены и составляют 0,14 нм. Благодаря приобретению ароматичности, рассматриваемый анион проявляет повышенную устойчивость, о чем свидетельствует его высокая для углеводорода кислотность (Ка=10-15; для сравнения - для циклогептатриена Ка=10-45). Ферроцен вступает также в типичные для ароматических соединений реакции электрофильного замещения: сульфирования, алкилирования и др.
На примере циклопропенил-катиона было уже показано, что ароматичностью может обладать и катион. Другим широко известным примером такого типа ионов может послужить циклогептатриенильный катион, называемый также тропилий-ионом
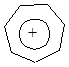
Оказалось, что тропилий-катион представляет собой правильный семиугольник, в котором шесть углеродов имеют по р-электрону, необходимых для образования ароматического секстета. Еще у одного углерода имеется не занятая р-орбиталь, которая обеспечивает возможность делокализации электронов и образования единого электронного облака. Как и следовало ожидать, тропилий-катион, например, в составе бромистого тропилия, обладает ароматическим характером. Он достаточно устойчив и легко вступает в реакции замещения.
Кроме рассмотренных случаев, ароматическая система делокализованных р-электронов может возникнуть и другими способами. Примерами могут послужить хорошо известные пятичленные гетероциклические соединения: фуран, пиррол и тиофен. Казалось бы, что этим соединениям никак не попасть в число ароматических. Хотя их молекулы циклические и имеют плоское строение, однако, у них не хюккелевское число р-электронов – всего 4. В то же время у молекул этих гетероциклов стремление к образованию термодинамически устойчивой ароматической системы настолько велико, что они «добирают» необходимый секстет р-электронов за счет вовлечения в сопряжение неподеленных электронных пар атомов кислорода, азота и серы
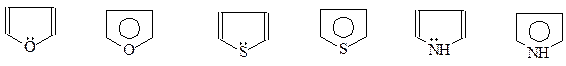
Участие в ароматическом сопряжении неподеленных р-электронов гетероатома легко может быть доказано. Так, пиррол, в отличие от вторичных аминов, не проявляет основности. А когда неподеленные электроны азота перестают участвовать в образовании замкнутой системы р-электронов, как это имеет место в гидрированной молекуле пиррола – пирролидине, то молекула сразу же приобретает основность, присущую вторичным аминам
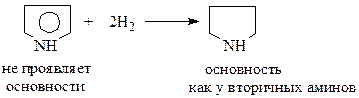
Как и следовало ожидать, пиррол, фуран и тиофен проявляют ароматичность. Подробнее это можно будет увидеть при рассмотрении химии этих соединений.
Наконец, отметим, что способы образования замкнутой системы делокализованных р-электронов отнюдь не исчерпываются рассмотренными примерами. Чтобы показать это рассмотрим молекулы коронена и порфина. Порфиновая система входит в молекулу важнейших природных систем, на которых построена жизнедеятельность живых организмов (гемоглобин) и растений (хлорофилл)
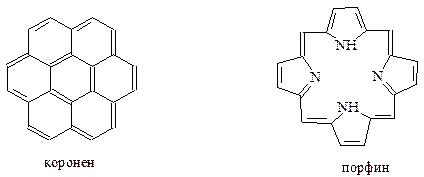
Из вышеприведенной формулы для коронена не следует, что это соединение будет обладать ароматичностью, т.к. не соблюдается требование правила Хюккеля относительно числа р-электронов. Здесь их всего 24, а должно быть 26 (при n=6). Между тем хорошо известно, что коронен проявляет ароматический характер. Каким же образом коронен «сделать» ароматическим по строению его молекулы? Оказывается, проблема решается, если представить коронен как бы состоящим из двух концентрических колец, причем одно из них находится внутри другого. Раздельный подсчет числа р-электронов для каждого из колец позволяет оба кольца отнести к ароматическим. Внутреннее кольцо имеет 6 электронов (n=1), внешнее кольцо включает 18 электронов (n=4). Таким образом, оба кольца содержат хюккелевское число р-электронов и должны быть отнесены к ароматическим системам.
Порфиновая ароматическая система сложена из 4 пиррольных колец, связанных между собой метиновыми группами. Формально в молекуле порфина можно насчитать 11 двойных связей, включающих 22 р-электрона. Кроме них в ароматическом сопряжении участвуют еще 8 р-электронов в составе неподеленных электронных пар у атомов азота. Суммарное число р-электронов 30 удовлетворяет требованиям правила Хюккеля при n=7.
Дата добавления: 2014-12-24; просмотров: 6306;
