Способы получения
Известно большое число химических реакций, позволяющих получить ароматические углеводороды исходя из других классов органических соединений. Те из них, которые основаны на превращениях соединений алифатического ряда, были уже рассмотрены. К ним относятся: дегидроциклизация алканов (Зелинский, Казанский, Платэ), тримеризация ацетилена (Бертло, Зелинский), циклическая кротоновая конденсация метилкетонов, дегидрирование гидроароматических углеводородов, диспропорционирование циклогексена, циклогексадиена и их гомологов (необратимый катализ Зелинского) и др. Число методов получения аренов может быть существенно расширено за счет модификации известных реакций, а также за счет специальных реакций.
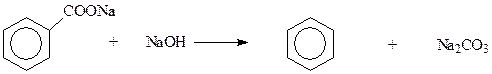
Декарбоксилирование солей ароматических карбоновых кислот при их нагревании со щелочью приводит к аренам
Оказалось, что метод создания С-С-связей по Вюрцу реакцией галогенпроизводных с щелочными металлами успешно может быть применен для синтеза гомологов бензола. Реакция в этом случае называется реакцией Вюрца-Фиттига (1864 г.)
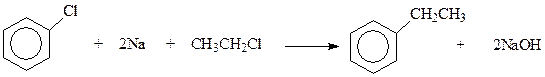
Известно, что необходимость использования в данной реакции смеси двух разных галогенпроизводных ограничивает синтетические возможности реакции, поскольку в результате реакции получается смесь из трех соединений. Это приводит к усложнению лабораторной процедуры и напрасному расходованию исходных материалов. Однако в случае реакции Вюрца-Фиттига дело несколько упрощается, поскольку продукты реакции легко разделяются из-за значительного различия в свойствах. Так, при использовании реакции Вюрца-Фиттига с целью получения этилбензола приходится исходить из хлорбензола и этилбензола. В результате реакции получаются этилбензол (жидкость), бифенил (твердое тело) и бутан (газ), которые легко разделяются. Вместе с тем необходимо отметить, что реакция Вюрца-Фиттига имеет лишь ограниченное применение в синтезе аренов.
Среди всех способов получения аренов особое место занимает алкилирование бензольного кольца в ароматических соединениях. Эта реакция на примере бензола и хлористого метила была впервые осуществлена еще в 1877 году Фриделем и Крафтсом
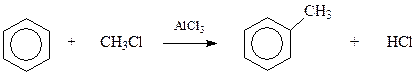
Значение реакции Фриделя-Крафтса в ее универсальности и возможности использования в промышленных процессах. В последующем будет рассмотрен механизм этой реакции как частного случая реакций электрофильного замещения в ароматическом ряду. Пока же обобщим феноменологические наблюдения над реакцией.
Способностью алкилироваться обладают многие ароматические соединения, но не все. Легко вступают в эту реакцию сам бензол и соединения, несущие в кольце так называемые электронодонорные заместители, в том числе и алкильные остатки. По этой причине реакция Фриделя-Крафтса сопровождается полиалкилированием, т.к. продукты первоначального алкилирования обладают большей реакционной способностью, чем исходный бензол. Попутно отметим, что последующая алкильная группа вступает в бензольное кольцо в о- и п-положение по отношению к имеющемуся заместителю
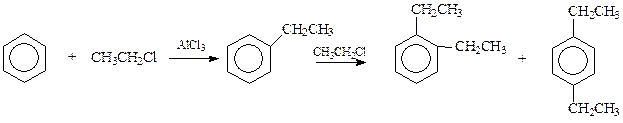
Препятствовать полиалкилированию в какой-то мере можно, используя в реакции избыток бензола.
Выше отмечалось, что в условиях реакции Фриделя-Крафтса легко алкилируются ароматические соединения, несущие в бензольном кольце электронодонорные заместители. Следует оговориться, что это не всегда так. Например, в случае анилина и замещенных аминов не удается успешно алкилировать бензольное кольцо, т.к. аминная группа как сильное основание образует с кислотой Льюиса комплекс и связывает катализатор.
Ароматические соединения с электроноакцепторными заместителями, например, нитробензол, бензолсульфокислота, в реакцию Фриделя-Крафтса практически не вступают.
Фридель и Крафтс для алкилирования бензола использовали галогеналканы. В последующем было показано, что как алкилирующие средства могут быть использованы не все галогенпроизводные. Не пригодны для этих целей соединения, в которых галоген прочно связан с остальной частью молекулы. Например, хлорбензол, хлористый винил и др.
Кроме галогеналканов, в качестве алкилирующих агентов могут быть использованы алкены и спирты. Однако независимо от природы алкилирующего агента, в результате реакции образуются продукты, у которых алкильный заместитель имеет иное строение, чем в исходном галогеналкане, спирте или алкене. Так, при алкилировании бензола хлористым пропилом, пропиленом или пропиловым спиртом получается не пропилбензол, а изопропилбензол
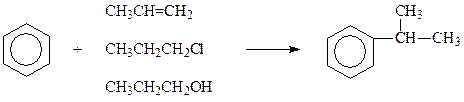
Классическим катализатором реакции Фриделя-Крафтса является хлористый алюминий. Однако реакцию катализируют и другие кислоты Льюиса. Чаще всего применяются трехфтористый бор, фтористоводородная и фосфорная кислоты.
Одним из способов получения аренов является трансформация уже имеющейся в ароматическом соединении боковой цепи в алкильную группу. Особенно часто этот подход осуществляется в отношении жирноароматических кетонов, легко получаемых ацилированием аренов. Благодаря особенностям строения такие кетоны способны восстанавливаться в арены по методу Клемменсена или Кижнера–Вольфа. В первом из них восстановление ведут амальгамированным цинком и соляной кислотой, во втором – гидразином и сильным основанием
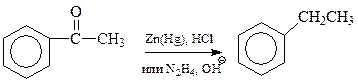
Особенностью рассматриваемого способа получения аренов является то, что в этом случае не происходит перегруппировки боковой цепи и становятся доступными арены с боковыми цепями нормального строения
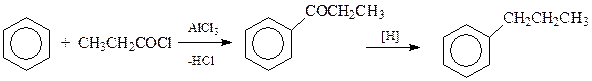
Для получения алкенилзамещенных аренов могут быть использованы все те реакции, которые позволяют получить алкены. В промышленности обычно используется дегидрирование алкилбензолов. Реакция проводится при высоких температурах в присутствии катализаторов дегидрирования – смеси оксидов алюминия, хрома и др.
Наиболее важный представитель алкенилбензолов - стирол получают по следующей схеме, включающей синтез этилбензола по Фриделю-Крафтсу и дегидрирование полученного этилбензола на оксидах хрома и алюминия при 6000C
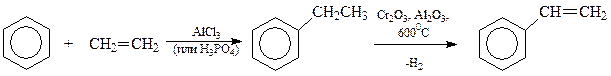
Аналогичная схема используется при промышленном получении еще одного из алкенилбензолов - α-метилстирола
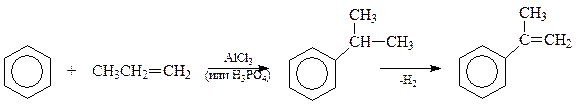
Дата добавления: 2014-12-24; просмотров: 8382;
