Энтропия. Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц друг
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц друг относительно друга.
Частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное. Количественной мерой беспорядка является энтропия S. Изменение энтропии ΔS в изолированной системе, переходящей из состояния 1 в состояние 2, можно определить соотношением
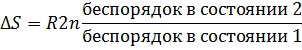
где R- газовая постоянная.
Если, например, баллон с газом соединить с вакуумированным сосудом, то газ из баллона будет распределяться по всему объёму сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком). Таким образом, при переходе системы из более упорядоченного состояния в менее упорядоченное состояние энтропия возрастает.
Переход же системы из менее упорядоченного состояния в более упорядоченное состояние связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере система самопроизвольно не может перейти из состояния 2 в состояние 1, т.е. невероятно, чтобы газ сам собой собрался в баллоне. В случае перехода системы из менее упорядоченного состояния в более упорядоченное ΔS системы - величина отрицательная, т.е. энтропия S системы уменьшается.
Энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества и т.д. В процессах конденсации и кристаллизации вещества энтропия уменьшается. Энтропия вещества в газовом состоянии значительно больше, чем в жидком, а тем более, чем в твердом.
Энтропии веществ, как и их теплоты образования, принято относить к определенным условиям, обычно при температуре 25 0С (298 К) и давлении 1 атм. Энтропию при этих условиях обозначают S0298 и называют стандартной энтропией.
Значениями энтропии веществ пользуются для установления изменения энтропии системы в результате соответствующих процессов. Так, для химической реакции
аА+bB+…= dD+еЕ+…изменение энтропии системы будет
ΔS= (dSD + eSE+…)-( aSA + bSB+...) или ΔS= ∑Sпрод. - ∑Sисх.
Об изменении энтропии в химических реакциях можно судить по изменению объёма системы в ходе реакции. Например, в реакции ½ С (графит)+½ СО2(г)=СО(г) наблюдается увеличение объёма ΔV>0; следовательно, энтропия возрастает ΔS> 0 (ΔS0298=87,7 дж/моль∙град). В случае же реакции образования Н3N из водорода и азота 3/2 Н2 (г)+1/2 N2 (г)= H3N(г) наоборот, объём системы уменьшается ΔV<0; следовательно, энтропия уменьшается ΔS<0 (ΔS0298=99,1дж/моль∙град).
Если же реакция протекает между твердыми веществами, например,
Аl(к)+Sb(к)=АlSb(к), то изменения объёма системы и её энтропии практически не происходит (ΔS0298=4,03дж/моль∙град). То же самое относится и к процессам, в которых число молей газообразных веществ не изменяется, например, С (графит)+ О2 (г)= СО2 (г), ΔS=2,9дж/моль∙град.
4.1.3. Энергия Гиббса и направленность химических процессов
Возможность самопроизвольного протекания химического процесса определяется двумя факторами: стремлением системы к понижению внутренней энергии за счет экзотермической реакции (-∆H) и стремлением системы к увеличению неупорядоченности в расположении частиц за счет теплового движения, мерой которой является функция состояния, называемая энтропией S.
Если ∆H незначительно зависит от температуры, то энтропия с повышением температуры сильно возрастает. Влияние как энтальпийного так и энтропийного факторов учитывается в уравнении ∆G=∆H-T∆S. Функцию G называют энергией Гиббса, она является мерой устойчивости системы в условиях T=const и p=const.
Состояние системы при постоянном объеме описывается функцией, которую называют энергией Гельмгольца: ∆P=∆U-T∆S. Таким образом, ∆G отличается от ∆P так же, как ∆H от ∆U на величину, равную работе расширения p∆V.
Изменение энергии Гиббса ∆G определяет возможность или невозможность самопроизвольного протекания процесса. Если ∆G<0, т.е. по ходу реакции происходит уменьшение энергии Гиббса, то этот процесс термодинамически возможен. Если ∆G>0, т.е. процесс ведет к увеличению энергии Гиббса, то такая реакция термодинамически невозможна. Если ∆G=0, то реакционная система находится в состоянии равновесия.
При положительном значении ∆S и, следовательно, T∆S величина G будет отрицательной: а) при любых отрицательных значениях Н, т.е. все экзотермические процессы в этом случае возможны; б) при положительных значениях ∆Н, но при условии, что по абсолютному значению ∆Н<T∆S, т.е. эндотермические реакции возможны, когда энтропийный фактор преобладает над энтальпийным, что легче реализуется с ростом температуры.
При отрицательном значении ∆S в уравнении ∆G=∆H-T∆S величина T∆S становится положительной, поэтому в этом случае эндотермические реакции (+∆Н) самостоятельно протекать не могут, так как ∆G будет величиной также положительной. Из экзотермических реакций (-∆Н) при таком условии возможны только те, которые характеризуются большим отрицательным значением ∆Н, т.е. те эндотермические реакции, для которых сумма -∆Н+(-Т∆S) имеет отрицательное значение.
При очень низких температурах величина Т∆S минимальна, так как и энтропия в этих условиях изменяется незначительно, поэтому преимущественное влияние на направление процесса имеет энтальпийный фактор и обычно процессы идут в сторону экзотермических реакций. В конденсированных системах реакции протекают с незначительным изменением энтропии, поэтому знак ∆G определяется знаком ∆Н.
Таким образом, для определения возможности протекания процесса при данных условиях надо найти знак ∆G. С этой целью в справочных таблицах находят стандартные значения ∆Н и S для веществ, участвующих в реакции, по которым вычисляют ∆G на формулы ∆Go298=∆H o298-T∆S o298 [3].
Пример 1. Расчет теплового эффекта химической реакции по теплоте образования реагирующих веществ и продуктов реакции.
Определите количество теплоты, выделяющейся при гашении 100кг извести водой при 25оС, если известны стандартные теплоты образования веществ, участвующих в химической реакции:
∆H o298, CaO(к) = -635,1 кДж∙моль-1;
∆H o298, H2O(ж) = -285,84 кДж∙моль-1;
∆H o298, Ca(OН)2(к) = -986,2 кДж∙моль-1.
Решение. Реакция гашения извести: СаО(к)+Н2О(ж)=Са(ОН)2(к). Согласно первому следствию из закона Гесса тепловой эффект химической реакции равен разности между суммой теплот образования реагирующих веществ с учетом стехиометрических коэффициентов:
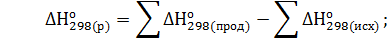
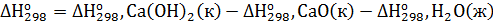 =
=
=-986,2-(-635,1)-(-285,84) = 65,26 кДж∙моль-1
Таким образом, при гашении водой 1 моль извести выделяется 65,26кДж, при гашении 1кмоль извести – 65260 кДж. М(СаО) = 56г∙моль-1=56кг∙моль-1; m(СаО) = 100кг;
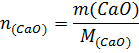
При гашении водой 100 кг извести выделяется 100/56∙65260=116536кДж.
Пример 2. Расчет теплоты образования.
Определить теплоту образования Са(ОН)2тв на основе реакций:
СаСО3→СаО+СО2+∆Н1; СаО+Н2О→Са(ОН)2тв+∆Н2.
Решение. Для определения суммарной теплоты образования ∆Н для этой реакции определяем ∆Н1 и ∆Н2, тогда ∆Н=∆Н1+∆Н2;
∆Н1=∆НСаО+∆Н(СО2)-∆НСаСО3 = +177,83 кДж∙моль-1;
∆Н2=∆НСа(ОН)2-∆НСаО-∆НН2О = -65,2 кДж∙моль-1;
∆Н= +177,83 – 65,2 = +113,61 кДж∙моль-1.
Пример 3. Рассчитайте тепловой эффект реакции горения сероводорода по следующим данным: Н2S(г) + 3/2O2=Н2О(ж) + SО2(г)
1)S(к) + Н2 = Н2S(г); ∆Н1= -20,17 кДж
2)Н2 + 1/2 O2 = H2O(ж); ∆Н2= -286,0 кДж
3)S(к) + О2 = SО2(г); ∆Н3= -297 кДж
Решение. Уравнение 1-3 есть термохимические уравнения образования соответственно 1 моль Н2S(г), Н2О(ж), SО2(г) из простых веществ в стандартных условиях: Т=298К и Р=101,325 кПа, а тепловые эффекты – стандартные энтальпии образования указанных соединений ∆H o298. Если сложить термохимические уравнения 2 и 3 и вычесть уравнение 1, получим искомое уравнение
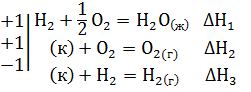
Н2S(г) + 3/2 O2 = H2O(ж) + SO2(г) ∆Н=∆Н1+∆Н2-∆Н3
Подставить численное значение энтальпий образования Н2S(г) , Н2О(ж), SO2(г), получим значение теплового эффекта реакции ∆Н= -286 -297 –(-20,17) = = -562,8 кДж. Отрицательное значение энтальпии реакции горения сероводорода означает, что данная реакция экзотермическая.
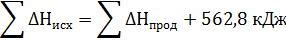
Тепловой эффект можно включить в уравнение химической реакции.
Н2S(г) + 3/2О2 = Н2О(ж) + SO2(г) + 562,8 кДж. Эта запись также представляет собой термохимическое уравнение реакции.
Пример 4. Определение изменения энтропии в стандартных условиях. Определить изменение энтропии реакции Na2O+SiO2=Na2SiO3 при температуре 298К.
Решение. Находим по справочнику значения энтропии продукта и исходных веществ при Т=298К, S o298, Na2O(т)=42,09Дж∙моль-1∙к-1:
S o298, SiO2 (т) = 71,1Дж∙моль-1∙к-1;
S o298, Na2SiO3 (т)=113,8Дж∙моль-1∙к-1. Изменение энтропии в химической реакции равно разности между суммой энтропий продуктов реакции и суммой энтропий исходных веществ с учетом стехиометрических коэффициентов.
So298 х.р. = So298, Na2SiO3(т) – So298, SiO2 (т) - So298, Na2O(т) = 113,8-71,1-42,09=0,61 Дж∙моль-1∙к-1
Пример 5. Определение изменения энтропии при фазовых превращениях. Определить изменение энтропии 1г кристобалита при температуре плавления 1986К, если теплота обратного фазового превращения кристобалита равна 744,05 Дж∙r-1.
Решение. Изменение энтропии при переходе вещества из одного агрегатного состояния в другое равно:  , где ∆Н-теплота обратимого фазового превращения.
, где ∆Н-теплота обратимого фазового превращения.
S2-S1=∆S= 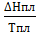 =
= 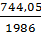 = 0,238Дж∙г-1∙град-1.
= 0,238Дж∙г-1∙град-1.
Пример 6.Вычислите 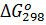 для химической реакции 2SO2(г)+О2(г)↔2SO3(г). В каком направлении может протекать эта реакция в стандартных условиях?
для химической реакции 2SO2(г)+О2(г)↔2SO3(г). В каком направлении может протекать эта реакция в стандартных условиях?
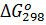 , SO2(г) = -300,37 кДж∙моль-1;
, SO2(г) = -300,37 кДж∙моль-1;
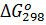 , SO3(г) = -370,37 кДж∙моль-1
, SO3(г) = -370,37 кДж∙моль-1
Решение. Изменение энергии Гиббса в химической реакции
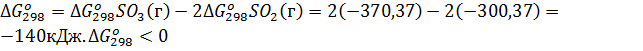 , поэтому в стандартных условиях данная реакция может протекать в сторону образования SO3.
, поэтому в стандартных условиях данная реакция может протекать в сторону образования SO3.
Дата добавления: 2014-12-24; просмотров: 2398;
