Катализ
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. В присутствии катализаторов изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость. Катализаторы — это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Изменение скорости катализируемой реакции за счет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ (∆G < 0):
А + В → А...В → АВ
Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии активации), образуя соединение АК:
А + К → А...К → АК
Соединение же АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К:
В + АК → В...АК → АВ + К
Суммируя два последних уравнения, получим А + В = АВ т.е. в результате реакции катализатор остался без изменения.
Пример 1. Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А+В=С; концентрация вещества А равна 6 моль∙л-1, а вещества В-5 моль∙л-1. Константа скорости реакции равна 0,5л2∙моль-2 с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной системе останется 45% вещества В.
Решение. Скорость химической реакции выражается уравнением υ=k[A]2[B]. Скорость химической реакции в начальный момент равна υ1=0,5∙62∙5=90,0 моль∙с-1∙л-1. Через некоторое время в реакционной смеси останется 45% вещества В, т.е. концентрация вещества В станет 5∙0,45=2,25моль∙л-1. Следовательно, концентрация вещества В уменьшилась на 5,0-2,25=2,75 моль∙л-1, а концентрация вещества А уменьшилась на 5,5 моль∙л-1 и стала равной 0,5моль∙л-1 (6-5,5). Отсюда υ2=0,5∙(0,5)2∙2,25=0,28 моль∙с-1∙л-1.
Пример 2. Влияние давления на скорости реакции.
Определите, как изменится скорость прямой реакции 2СО+О2=2СО2, если общее давление в системе увеличить в 4 раза.
Решение. При увеличении давления в 4 раза объем системы уменьшится в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Тогда υ1=k[CO]2[O2], а υ2= k[4CO]2[4O2];
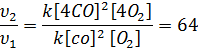
Дата добавления: 2014-12-24; просмотров: 841;
