Принцип Ле Шателье
Состояние химического равновесия сохраняется при данных неизменных условиях любое время. При изменении же условий состояние равновесия нарушается, так как при этом скорости противоположных процессов изменяются в разной степени. Однако спустя некоторое время система снова приходит в состояние равновесия, но уже отвечающее новым изменившимся условиям.
Смещение равновесия в зависимости от изменения условий в общем виде определяется принципом Ле-Шателье (или принципом подвижного равновесия): если на систему, находящуюся в равновесии, оказывать воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведенного воздействия.
Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении. Подобно этому повышение давления смещает равновесие в направлении процесса, сопровождающегося уменьшением объема, а понижение давления действует в противоположную сторону. Например, в равновесной системе 3Н2+N2  2H3N, ∆Ho= -46,2 кДж повышение температуры усиливает разложение H3N на водород и азот, так как этот процесс эндотермический. Повышение давления смещает равновесие в сторону образования H3N, ибо при этом уменьшается объем.
2H3N, ∆Ho= -46,2 кДж повышение температуры усиливает разложение H3N на водород и азот, так как этот процесс эндотермический. Повышение давления смещает равновесие в сторону образования H3N, ибо при этом уменьшается объем.
Если в систему, находящуюся в состоянии равновесия, добавить некоторое количество какого-либо из веществ, участвующих в реакции (или наоборот, удалить из системы), то скорости прямой и обратной реакций изменяются, но постепенно снова уравниваются. Иными словами, система снова приходит к состоянию химического равновесия. В этом новом состоянии равновесные концентрации всех веществ, присутствующих в системе, будут отличаться от первоначальных равновесных концентраций, но соотношение между ними останется прежним. Таким образом, в системе, находящейся в состоянии равновесия, нельзя изменить концентрацию одного из веществ, не вызвав изменения концентраций всех остальных.
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается и соответственно увеличивается концентрация продуктов его взаимодействия.
Изучение химического равновесия имеет большое значение как для теоретических исследований, так и для решения практических задач. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. При окончательном выборе условий проведения процесса учитывают также их влияние на скорость процесса.
Пример 1. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ.
Вычислите константу равновесия реакции А+В  2С, если равновесные концентрации [А]=0,3моль∙л-1; [В]=1,1моль∙л-1; [С]=2,1моль∙л-1.
2С, если равновесные концентрации [А]=0,3моль∙л-1; [В]=1,1моль∙л-1; [С]=2,1моль∙л-1.
Решение. Выражение константы равновесия для данной реакции имеет вид: 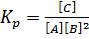 . Подставим сюда указанные в условии задачи равновесные концентрации:
. Подставим сюда указанные в условии задачи равновесные концентрации: 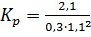 =5,79.
=5,79.
Пример 2. Вычисление равновесных концентраций реагирующих веществ. Реакция протекает по уравнению А+2В  С.
С.
Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль∙л-1, а константа равновесия реакции Кр=50.
Решение. На каждый моль веществ А и В образуется 2 моль вещества С. Если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества будет равно 2Х моль. Равновесные концентрации реагирующих веществ будут:
СА=(о,5-х)моль∙л-1; СВ=(0,7-х)моль∙л-1; СС=2х моль∙л-1
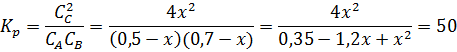
х1=0,86; х2=0,44
По условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны:
СА=0,5-0,44=0,06моль∙л-1; СВ=0,7-0,44=0,26моль∙л-1; СС=0,44∙2=0,88моль∙л-1.
Пример 3. Определение изменения энергии Гиббса ∆Go реакции по значению константы равновесия Кр. Рассчитайте энергию Гиббса и определите возможность протекания реакции СО+Cl2=COCl2 при 700К, если константа равновесия равна Кр=1,0685∙10-4. Парциальное давление всех реагирующих веществ одинаково и равно 101325Па.
Решение. ∆G700=2,303∙RT 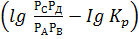 .
.
Для данного процесса: 
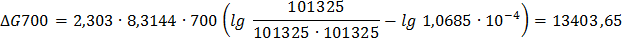
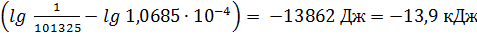
Так как ∆Gо<0, то реакция СО+Cl2  COCl2 при 700К возможна.
COCl2 при 700К возможна.
Пример 4. Смещение химического равновесия. В каком направлении сместится равновесие в системе N2+3H2  2NH3-22ккал:
2NH3-22ккал:
а) при увеличении концентрации N2;
б) при увеличении концентрации Н2;
в) при повышении температуры;
г)при уменьшении давления?
Решение. Увеличение концентрации веществ, стоящих в левой части уравнения реакции, по правилу Ле-Шателье должно вызвать процесс, стремящийся ослабить оказанное воздействие, привести к уменьшению концентраций, т.е. равновесие сместится вправо (случаи а и б).
Реакция синтеза аммиака – экзотермическая. Повышение температуры вызывает смещение равновесия влево – в сторону эндотермической реакции, ослабляющей оказанное воздействие (случай в).
Уменьшение давления (случай г) будет благоприятствовать реакции, ведущей к увеличению объема системы, т.е. в сторону образования N2 и Н2.
Пример 5.Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г) + О2(г)  2SO3(r) если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
2SO3(r) если объем газовой смеси уменьшится в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]=а, [Q2]=b, [SO3]=с. Согласно закону действующих масс, скорости прямой и обратной реакций до изменения объема равны
vпр= Ка2b, vобр = К1с2
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v'np прямой и обратной реакций:
v'np = K(3a)2 (3b) = 27 Ka2b; vo6p = K1(3c)2 = 9K1c2 .
Отсюда
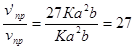 ;
; 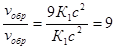
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 6.Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 0С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
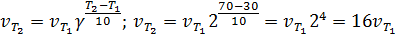
Следовательно, скорость реакции 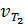 при 70°С большескорости реакции
при 70°С большескорости реакции 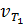 при 30° С в 16 раз.
при 30° С в 16 раз.
Пример 7.Константа равновесия гомогенной системы
СО(г) + Н2О(г)  СО2(г) + Н2(г) при 850°С равна 1. Вычислите концентрации всех веществ
СО2(г) + Н2(г) при 850°С равна 1. Вычислите концентрации всех веществ  при равновесии, если исходные концентрации: [СО]ИСХ = 3 моль/л, [Н2О]ИСХ = 2 моль/л.
при равновесии, если исходные концентрации: [СО]ИСХ = 3 моль/л, [Н2О]ИСХ = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Vnp = К 1 [СО][Н2О]; Voбp = К2[СО2][Н2];
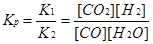
В условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрация [СО2]Р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ (моль/л):
[СО2]Р = [Н2]р = х; [СО]Р = (3 –х); [H2O]P =(2-х).
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
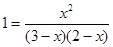 ; х2=6-2х-3х + х2; 5х = 6, л = 1,2 моль/л.
; х2=6-2х-3х + х2; 5х = 6, л = 1,2 моль/л.
Таким образом, искомые равновесные концентрации: [СО2]Р = 1,2 моль/л; [Н2]р = 1,2 моль/л; [СО]Р= 3 - 1,2 = 1,8 моль/л; [Н2О]Р = = 2- 1,2 = 0,8 моль/л.
Пример 8.Эндотермическая реакция разложения пента-хлорида фосфора протекает по уравнению
РС15(г)  РС13(г) + С12(г); ∆Н = +92,59 кДж.
РС13(г) + С12(г); ∆Н = +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье: а) так как реакция разложения РС15 эндотермическая (∆Н > 0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру: б) так как в данной системе разложение РС15 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РС15, так иуменьшением концентрации РСl3 или С12.
Дата добавления: 2014-12-24; просмотров: 2443;
