Энтропия. Второй закон термодинамики позволяет разделить все процессы на обратимые и необратимые
Второй закон термодинамики позволяет разделить все процессы на обратимые и необратимые. Мера необратимости процесса определяется изменением функции состояния - энтропии.
Энтропия – это термодинамическая функция, которая является функцией состояния и изменение которой для обратимого изотермического перехода теплоты равно приведенной теплоте процесса.
Обозначается энтропия буквой S.
Для обратимого изотермического перехода теплоты
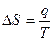
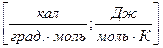 (19)
(19)
Для обратимого изотермического перехода бесконечно малого количества теплоты:
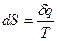 (20)
(20)
Энтропия является функцией состояния, следовательно, для перехода из состояния 1 в состояние 2 изменение энтропии определяется уравнением:
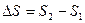 .
.
Согласно уравнению (19)
в обратимых изотермических процессах изменение энтропии равно тепловому эффекту процесса, деленному на абсолютную температуру.
Процессы, которые протекают самопроизвольно являются необратимыми процессами (например, переход теплоты от более нагретого тела к менее нагретому, переход газа из сосуда с большим давлением в сосуд с меньшим давлением).
Необратимые процессы, протекающие в изолированных системах, всегда сопровождаются возрастанием энтропии системы.
При необратимом процессе
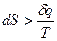 , (21)
, (21)
Это неравенство означает, что по мере самопроизвольного развития необратимого процесса его энтропия возрастает и достигает максимального значения в состоянии равновесия.
В общем случае для обратимых и необратимых процессов:
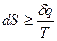 . (22)
. (22)
Величина энтропии изменяется с температурой. Энтропия вещества при любой температуре может быть рассчитана по формуле:
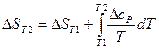 . (23)
. (23)
При протекании химических реакций изменение энтропии рассчитывается аналогично расчету теплового эффекта реакции (11) и изменению теплоемкости (17) по уравнению:
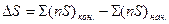 , (24)
, (24)
где n – количество молей вещества, участвующего в реакции, S – энтропия вещества при температуре реакции.
Дата добавления: 2014-12-05; просмотров: 1476;
