Метод гипервалентных связей

Метод МО, основанный на рассмотрении химических соединений как единой системы с делокализованными молекулярными орбиталями, позволяет получить наиболее полное описание электронного строения разнообразных химических соединений. Причем, чем в большей степени делокализованы в пространстве исходные АО компонентов системы, тем большей степенью делокализации характеризуются и образующиеся из них МО. В связи с этим, наиболее существенные различия между двумя квантовохимическими методами описания электронного строения химических соединений - на основе делокализованных многоцентровых молекулярных орбиталей (метод МО) и локализованных двухцентровых двухэлектронных связей (метод ВС) наблюдается для соединений переходных элементов, характеризующихся участием в химических связях трехмерно делокализованных d- и f-орбиталей. В тоже время, валентные s- и р-орбитали, участвующие в образовании химических связей в соединениях непереходных элементов, в значительной степени локализованы в пространстве между соседними атомами и, как следствие этого, молекулярные орбитали на их основе носят преимущественно двух- и трехцентровый характер. Это позволяет рассматривать электронное строение соединений непереходных элементов на основе совокупности двух- и трехцентровых взаимодействий валентных np- и ns-орбиталей центрального атома с лигандами без участия свободных nd-орбиталей. Такой подход описания электронного строения соединений непереходных элементов получил название метода гипервалентных связей (ГВС).
В методе ГВС различают следующие взаимодействия, приводящие к образованию соединений непереходных элементов:
- ковалентные двухцентровые двухэлектронные химические связи (CV), возникающие при взаимодействии занятой одним электроном валентной р-орбитали центрального атома (А) с занятой неспаренным электроном валентной р-орбиталью лиганда (Х), при этом образуется заполненная электронами s-связывающая и свободная s*-разрыхляющая МО. Такие химические связи А-Х характеризуются единичной кратностью, относительно высокой энергией связи и являются устойчивыми. Соединениями с ковалентными двухцентровыми двухэлектронными связями являются – например, ClF, SF2, PF3 с одной, двумя и тремя ковалентными связями центрального атома с фторидными лигандами;
- 
 гипервалентные (HV) трехцентровые четырехэлектронные связи (их называют также орбитально-дефицитными), в каждой из которых занятая парой электронов р- или s-орбиталь центрального атома (А) взаимодействует с двумя валентными орбиталями лигандов (Х), занятых по одному электрону. При этом образуются трехцентровые s-связывающая и s*-разрыхляющая МО, а также несвязывающая МО, локализованная на лигандах. В зависимости от того р- или s-орбиталь центрального атома участвует в образовании гипервалентной связи, различают соответственно гипервалентные–1 (HV-1 – ClF3, ClF5, SF4) и гипервалентные-2 (HV-2 – ClF7, SF6, PF5) связи. Трехцентровые МО связей HV-1 линейных фрагментов Х-А-Х направлены вдоль соответствующих осей координат под прямым углом. В случае HV-2 связей участие ns орбиталей центрального атома А в высшей степени окисления обеспечивает наиболее симметричную геометрию молекулы. За счет большего экранирования внутренними электронными слоями валентных s-электронов центрального атома по сравнению с р-электронами, связи HV-1 являются относительно более прочными, чем HV-2.
гипервалентные (HV) трехцентровые четырехэлектронные связи (их называют также орбитально-дефицитными), в каждой из которых занятая парой электронов р- или s-орбиталь центрального атома (А) взаимодействует с двумя валентными орбиталями лигандов (Х), занятых по одному электрону. При этом образуются трехцентровые s-связывающая и s*-разрыхляющая МО, а также несвязывающая МО, локализованная на лигандах. В зависимости от того р- или s-орбиталь центрального атома участвует в образовании гипервалентной связи, различают соответственно гипервалентные–1 (HV-1 – ClF3, ClF5, SF4) и гипервалентные-2 (HV-2 – ClF7, SF6, PF5) связи. Трехцентровые МО связей HV-1 линейных фрагментов Х-А-Х направлены вдоль соответствующих осей координат под прямым углом. В случае HV-2 связей участие ns орбиталей центрального атома А в высшей степени окисления обеспечивает наиболее симметричную геометрию молекулы. За счет большего экранирования внутренними электронными слоями валентных s-электронов центрального атома по сравнению с р-электронами, связи HV-1 являются относительно более прочными, чем HV-2.
- 
 орбитально-избыточные (OS) трехцентровые двухэлектронные связи, в каждой из которых занятая неспаренным электроном валентная орбиталь центрального атома А взаимодействует с двумя валентными орбиталями лигандов, содержащими один электрон. При этом также образуется три МО, нижняя связывающая из которых занята парой электронов. Образование OS-связей характерно для электронно-дефицитных молекул – например, диборана B2H6, общее число валентных электронов которых 12 не хватает для образования 8 двухэлектронных двухцентровых связей. Две концевые группы BH2 лежат в одной плоскости, а атомы B и H образуют двухцентровые CV связи. Два же центральных атома водорода расположены симметрично выше и ниже этой плоскости и объединены трехцентровыми B-H-B орбитально-избыточными связями.
орбитально-избыточные (OS) трехцентровые двухэлектронные связи, в каждой из которых занятая неспаренным электроном валентная орбиталь центрального атома А взаимодействует с двумя валентными орбиталями лигандов, содержащими один электрон. При этом также образуется три МО, нижняя связывающая из которых занята парой электронов. Образование OS-связей характерно для электронно-дефицитных молекул – например, диборана B2H6, общее число валентных электронов которых 12 не хватает для образования 8 двухэлектронных двухцентровых связей. Две концевые группы BH2 лежат в одной плоскости, а атомы B и H образуют двухцентровые CV связи. Два же центральных атома водорода расположены симметрично выше и ниже этой плоскости и объединены трехцентровыми B-H-B орбитально-избыточными связями.
Гипервалентные орбитально-дефицитные и орбитально-избыточные связи по сравнению с ковалентными характеризуются меньшей кратностью [К = (2-0)/(2×2) = 1/2) и энергией индивидуальной А-Х связи. Анализ перераспределения электронной плотности между центральным атомом и лигандами при образовании гипервалентных связей -dХ 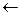 А+2d
А+2d 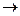 Хd- показывает, что выигрыш в энергии системы по сравнению с исходными атомами, зависит от энергетического положения s-связывающей МО по отношению к энергии валентной орбитали центрального атома. Поскольку энергия s-связывающей МО, преимущественно локализованной на лигандах, в основном определяется энергетическим положением атомных орбиталей лигандов, то энергия гипервалентной Х-А-Х связи тем больше, чем больше энергетический зазор между исходными атомными орбиталями центрального атома и лигандов, т. е. чем больше разница в относительных электроотрицательностях между А и Х.
Хd- показывает, что выигрыш в энергии системы по сравнению с исходными атомами, зависит от энергетического положения s-связывающей МО по отношению к энергии валентной орбитали центрального атома. Поскольку энергия s-связывающей МО, преимущественно локализованной на лигандах, в основном определяется энергетическим положением атомных орбиталей лигандов, то энергия гипервалентной Х-А-Х связи тем больше, чем больше энергетический зазор между исходными атомными орбиталями центрального атома и лигандов, т. е. чем больше разница в относительных электроотрицательностях между А и Х.
Таким образом, электронное строение и свойства соединений непереходных элементов в рамках метода ГВС можно приближенно описать на основе единой системы МО, являющихся индивидуальной совокупностью трех типов взаимодействий – CV, HV и OS.
Пример 1. Описать электронное строение и структуру фторидов ксенона: XeF2, XeF4, XeF6 и XeF8.
Решение. Валентными орбиталями, участвующими в образовании химических связей фторидов ксенона являются 5s2- и 5р6-орбитали центрального атома Xe и 2р5-орбитали фторидных лигандов. В результате взаимодействия заполненной электронами px-орбитали Xe с частично заполненными px-орбиталями двух атомов фтора образуется трехцентровая четырехэлектронная гипервалентная связь (HV-1):

Схема 19. Молекулярные орбитали XeF2.
Электронное строение молекул тетрафторида XeF4 и гексафторида XeF6 описывается образованием соответственно двух и трех HV-1 связей в результате взаимодействия валентных px, py и px, py, pz орбиталей атома Xe с соответствующими орбиталями фторидных лигандов:

Схема 20. Гипервалентные связи в молекулах XeF4 и XeF6.
Образование линейных трехцентровых HV-1 связей с участием р-орбиталей ксенона определяет линейную, плоскоквадратную и октаэдрическую структуру молекул XeF2, XeF4 и XeF6.
Наряду с валентными 5р-орбиталями, в образовании гипервалентных связей могут участвовать и заполненные 5s-орбитали атома ксенона. Взаимодействие их с р-орбиталями дополнительных двух атомов фтора определяет существование молекулы XeF8, электронное строение которой характеризуется наличием трех HV-1 и одной HV-2 связей. Геометрическое строение молекулы XeF8 – квадратная антипризма – соответствует наиболее симметричному расположению 8 лигандов вокруг атома ксенона. В связи с меньшей прочностью связей HV-2 по сравнению с HV-1 наименее устойчивым среди фторидов ксенона является XeF8.
Пример 2. Описать электронное строение полииод-инов [In]-, образующихся в водных растворах при взаимодействии иодидов щелочных металлов с молекулярным иодом: I- + n/2I2 = [In]-. С каким максимальным значением n возможно образование полииодид-ионов?
Решение. Электронное строение полииодид-ионов [In]- может быть описано на основе последовательного образования гипервалентных связей в результате взаимодействия каждой из заполненных электронами валентных 5p- и 5s-орбиталей центрального иодид-иона I- с частично заполненными р-орбиталями двух атомов иода. Это определяет следующий ряд полииодид-ионов: [I3]-, [I5]- и [I7]- - с одной, двумя и тремя гипервалентная HV-1 связями за счет взаимодействия 5рx, 5py и 5pz-орбиталей центрального иодид-иона с двумя р-орбиталями атомов иода, и [I9]-, характеризующийся тремя HV-1 и одной HV-2 связями в результате дополнительного взаимодействия 5s-орбитали иодид-иона с двумя р-орбиталями атомов иода. Таким образом максимальное число n для полииодид ионов не превышает 9.
Возможность образования и относительная устойчивость гипервалентных связей полииодидных ионов определяется более высокой энергией заполненных электронами валентных 5s- и 5p-орбиталей центрального иодидного иона по сравнению с частично заполненными 5p-орбиталями атомов иода, выступающих в качестве лигандов.
Пример 3. На примере соединений халькогенов обосновать применимость эмпирического правила «N-2» для наиболее устойчивых степеней окисления элементов в их соединениях. С чем связано исключение из этого правила для соединений кислорода?
Решение. В соответствии с эмпирическим правилом «N-2» для р-элементов 6 группы (халькогенов) наиболее устойчивыми являются соединения со степенями окисления +6, +4, +2, 0 и –2. Наличие у атомов халькогенов (ns2np4) двух неспаренных электронов на р-орбиталях определяет возможность образования ими с партнерами двух ковалентных двухцентровых двухэлектронных химических связей. Причем, поскольку такие связи могут быть образованы независимо от соотношения относительных электроотрицательностей элемента Э и партнера Х, то для всех элементов 6 группы характерно образование соединений как с формально положительной +2 (OF2, SO, SeCl2, TeI2), так и отрицательной –2 (халькогениды - Na2O, K2S, CaSe, BaTe) степенью окисления элемента. В тоже время, дополнительное образование одной (HV-1) или двух (HV-1 + HV-2) трехцентровых гипервалентных связей с участием электронных пар на валентных np и ns-орбиталях атомов халькогенов возможно только с более электроотрицательными партнерами. Как следствие этого, в соединениях с гипервалентными химическими связями HV-1 и HV-2 формальная степень окисления элемента может быть только положительной: +4 (SF4,, SeCl4, TeCl4) и +6 (SF6, SeF6, TeF6).
Так как гипервалентные связи являются относительно устойчивыми только при взаимодействии центрального атома с более электроотрицательными лигандами, а кислород сам является одним из наиболее электроотрицательных элементов, то образование устойчивых соединений кислорода в степени окисления +4 и +6 не возможно.
 Упражнения:
Упражнения:
115. В рамках метода ГВС описать электронное строение и определить геометрическую структуру следующих соединений: а) ClF, ClF2+, ClF2-, ClF3, ClF4+, ClF4+, ClF4-, ClF5, ClF6+, ClF6-, ClF7; б) SF2, SF3+, SF3-, SF4, SF5-, SF6.
116. Как и почему изменяется устойчивость следующих соединений благородных газов: а) KrF2, XeF2, RnF2; б) XeF2, XeCl2? С какими еще (кроме фтора) лигандами могут быть получены относительно устойчивые соединения ксенона?
117. На примере соединений р-элементов 5 группы обосновать применимость эмпирического правила «N-2» для наиболее устойчивых степеней окисления элементов в их соединениях. С чем связано исключение из этого правила для соединений азота?
118. Как и почему изменяется устойчивость полигалогенидных ионов [Haln]- в зависимости от природы галогенов?
119. Почему молекулы простых веществ галогенов двухатомны Hal2, тогда как, для межгалойдных соединений, наряду с двухатомными молекулами (ClF, BrF, IF, BrCl, ICl, IBr), известны и полиатомные соединения (ClF3, BrF3, IF3, ICl3, ClF5, BrF5, IF5, ClF7, BrF7, IF7)? Как и почему изменяется устойчивость межгалойдных соединений в ряду: а) ClF3, BrF3, IF3; б) IF3, ICl3, IBr3?
Дата добавления: 2014-12-20; просмотров: 5671;
