Метод валентных связей. Застройка внешнего энергетического уровня до конфигурации s2 или s2p6, в соответствии с представлениями Льюиса
Застройка внешнего энергетического уровня до конфигурации s2 или s2p6, в соответствии с представлениями Льюиса, осуществляется путем обобществления электронов взаимодействующих атомов с образованием общих электронных пар.
Такую связь называют ковалентной, гомеополярной, атомной, парноэлектронной.
Пример образования молекул H2, Cl2, O2. (На самоподготовке изобразить образование связей в молекулах N2 и HCl).
Сначала записывают БЦЭФ и ГЭФ взаимодействующих атомов, а затем объединяют между собой орбитали, за счет которых образуются связи.
Н2
Н0 БЦЭФ Н0
1s1 1s1
 |
|
 Н Н
Н Н

Н2
Cl2
Cl БЦЭФ Cl
1s22s22p63s235
 |
| ¯ | ¯ | ¯ | | ¯ | ¯ | ¯ | ¯ | ||||||
| ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ¯ | ||||||
 ¯ ¯
| 
|
| ¯ |
|
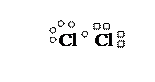 |
|
|

Cl – Cl
Cl2
О2
O0 БЦЭФ О0
 1s22s22p4
1s22s22p4
 |
| ¯ | ¯ | | | ¯ | ¯ | ¯ | ¯ | ||||
 ¯ ¯
| 
| ¯ |
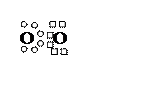
|
|
|
|
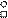 |
О = О
О2
Существует два способа (механизма) обобществления электронов:
- обменный механизм (см. примеры выше);
- донорно-акцепторный.
Во втором случае при образовании химической связи один атом представляет пару электронов (донор), а другой атом – свободную орбиталь. Например: образование молекулы водорода из гидрид-иона и протона водорода.
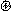 | 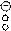 | ||
 Н Н
Н Н
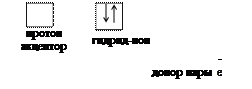 |

 | |||
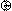 | |||
Н + Н = Н2
 |
NH3 + Н ® NH4
Современное учение о химической связи основано на квантовомеханических представлениях. Для описания химической связи в настоящее время широко используются два метода: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Таким образом, в соответствии с методом ВС ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит одновременно двум атомам. Сами же атомы сохраняют свою индивидуальность.
Ковалентная химическая связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
В широком смысле слова ковалентная связь – это химическая связь между атомами, осуществляемая путем обобществления электронов. Ковалентную связь можно рассматривать как универсальный, самый распространенный тип химической связи.
Для точного описания состояния электрона в молекуле необходимо решить уравнение Шредингера для соответствующей системы электронов и ядер, задавшись условием минимума энергии. Однако, в настоящее время решение уравнения Шреденгера возможно лишь для самых простых систем. Впервые приближенный расчет волновой функции электрона был произведен в 1927 году Гейтлером и Лондоном для молекулы водорода. В результате проведенной работы они получили уравнение, связывающее потенциальную энергию системы с расстоянием между ядрами двух атомов водорода. При этом оказалось, что результаты расчетов зависят от того, одинаковы или противоположны по знаку спины обоих электронов. При параллельных спинах сближение атомов приводит к непрерывному возрастанию энергии системы. При противоположно направленных спинах сближение атомов до некоторого расстояния r0 сопровождается снижением энергии системы, после чего она вновь начинает возрастать (рисунок 1).
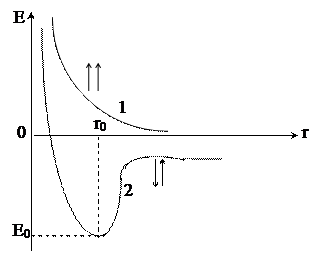 |
Рис. 1. Зависимость энергии системы из двух атомов водорода от
межядерного расстояния в случае электронов
с параллельными спинами (1) и антипараллельными (2) спинами
Таким образом, в первом случае образования химической связи по энергетическим причинам не происходит, в случае же противоположно направленных спинов электронов образуется молекула Н2 – устойчивая система из двух атомов водорода, расстояние между ядрами которых составляет r0.
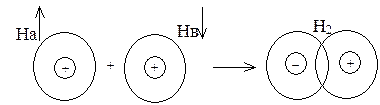 |
Это расстояние r0 существенно меньше удвоенного атомного радиуса (для молекулы водорода – соответственно 0,074 и 0,106 нм), следовательно, при образовании химической связи происходит взаимное перекрывание электронных облаков, реагирующих атомов (рис. 2).
Рис. 2. Схема перекрывания электронных облаков при образовании
молекулы водорода
Вследствие перекрывания облаков электронная плотность между ядрами повышается, при этом возрастают силы притяжения между этой областью отрицательного заряда и положительно заряженными ядрами взаимодействующих атомов. Возрастание сил притяжения сопровождается выделением энергии, что и приводит к образованию химической связи.
Дата добавления: 2014-12-20; просмотров: 1677;
