Энергия связи
Энергия связи служит мерой прочности любой химической связи. На разрыв химической связи необходимо затратить энергию, равную по величине той энергии, которая выделилась при образовании химической связи.
Количество энергии, выделяющейся при образовании молекулы из атомов, называют энергией образования связи илипросто энергией связи.
Энергию связи выражают в кДж/моль, например:
Н + Н ® Н2 + 435 кДж.
Естественно, столько же энергии необходимо затратить и для разрыва химических связей в 1 моль водорода. Следовательно, чем больше энергия связи, тем связь прочнее. Например, ЕСВ(Н2) = 435 кДж/моль, а ЕСВ(N2) = 942 кДж/моль. И, действительно, связь в молекуле азота (как показано ранее, тройная) значительно прочнее связи в молекуле водорода.
Разрыв связи может быть осуществлен гомолитически (с образованием нейтральных атомов) и гетеролитически (с образованием ионов), причем энергия разрыва может различаться.
NaCl(г) = Na(г) + Clг – 414 кДж
 |
NaCl(г) = Na (г) + Cl (г) – 548 кДж
Следовательно, в каждом конкретном случае следует указывать, какой процесс имеется в виду.
Длина связи - это расстояние между центрами атомов, образующих химическую связь. Обозначают ее d или ℓ и выражают в нанометрах (1 нм = 1 × 10-9 м) или ангстремах (1 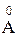 = 1 × 10-10 м)
= 1 × 10-10 м)
 |
Для однотипных молекул длина химической связи также может служить характеристикой прочности связи: ведь чем меньше длина связи, тем больше степень перекрывания электронных облаков.
Так, длина связей ℓ (HF) = 0,092 нм и ℓ (HJ) = 0,162 нм свидетельствуют о большей прочности связи в молекуле фтороводорода, что подтверждается на практике.
Следует отметить, что экспериментально определяемые длины связей характеризуют лишь среднее расстояние между атомами, поскольку атомы в молекулах и кристаллах совершают колебания около положения равновесия.
Перекрывание электронных облаков, приводящее к образованию химической связи, возможно лишь при их определенной взаимной ориентации. Область перекрывания также расположена в определенном направлении к взаимодействующим атомам. Поэтому говорят, что ковалентная химическаясвязь обладает направленностью. При этом могут возникать связи 3 видов, которые называют s- (сигма), p- (пи) и d- (дельта) связями.
В рассмотренных выше случаях образования молекул Н2 и Cl2 перекрывание электронных облаков происходит вдоль прямой, соединяющей центры атомов. Ковалентная связь, образующаяся в результате перекрывания электронных облаков вдоль линии, соединяющей центры атомов, называется s-связью. s-связь образуется (рис. 3) при перекрывании s – s – облаков (например, Н2), рх – рх – облаков (Cl2), s – px (HF).
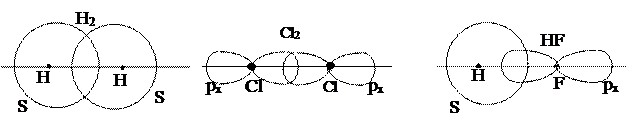
а б в
Рис. 3. s-связи в молекулах Н2 (а), Cl2 (б), HF (в)
При взаимодействии р-электронных облаков, ориентированных перпендикулярно оси, соединяющей центры атомов (ру– и рz – облака) образуются две области перекрывания, расположенные по обе стороны от оси. Такое положение отвечает образованию p- связи.
p-связь – это связь, для которой связывающее электронное облако имеет плоскость симметрии, проходящую через атомные ядра.
p-связь не существуют сами по себе: они образуются в молекулах, уже имеющих s-связи, и приводит к появлению двойных и тройных связей.
Так, в молекуле N2 каждый атом азота обладает тремя неспаренными
2р – электронами. По одному облаку от каждого атома азота участвует в образовании s-связи (рх – рх - перекрывание).
Облака же ру – и рz – направленные перпендикулярно линии s-связи, могут перекрываться между собой лишь боковыми сторонами “гантелей“. Такое перекрывание приводит к образованию двух p-связей, т.е. связь в молекуле N2 является тройной. Однако эти связи энергетически неравноценны: степень перекрывания рх – рх – облаков много выше, чем ру – ру и рz – рz. И, действительно, энергия тройной связи ниже, чем утроенная энергия одной s - связи, а при химических реакциях в первую очередь происходит разрыв p - связей.
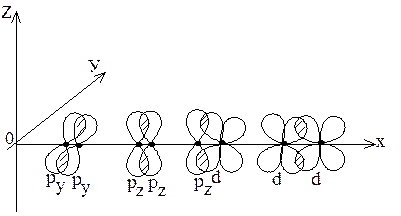 |
p-связи образуются при перекрывании ру – ру, рz – рz, ру – d, рz – d, d – d – облаков (рисунок 4).
Рис. 4. Различные случаи образования p-связей


 ¶ -связь – это ковалентная связь, образованная при перекрывании
¶ -связь – это ковалентная связь, образованная при перекрывании
d – электронных облаков всеми четырьмя лепестками (рисунок 5). По прочности она также значительно уступает s-связи.
 |
Рис. 5. Схема образования ¶-связи
Дата добавления: 2014-12-20; просмотров: 3324;
