Водородная связь. Водородная связь реализуется между положительно поляризовнными атомом водорода одной полярной молекулы и отрицательно поляризованным атомом неметалла (чаще –
Водородная связь реализуется между положительно поляризовнными атомом водорода одной полярной молекулы и отрицательно поляризованным атомом неметалла (чаще – фтора, кислорода, азота, реже – хлора, серы) другой молекулы. Подобное взаимодействие не проявляется для других атомов, что обусловлено уникальными свойствами поляризованного атома водорода – его очень малыми размерами и отсутствием внутренних электронных оболочек. Эти особенности атома водорода позволяют партнеру приблизиться на столь малое расстояние, которое не может быть достигнуто при взаимодействии с другими частицами.
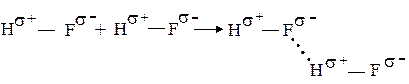 |
Возникновение водородной связи в очень грубом приближении можно объяснить действием электростатических сил. Так, например, в полярной молекуле фтороводорода общая электронная пара сильно смещена к атому фтора. В результате атом водорода приобретает положительный заряд и может электростатически взаимодействовать с отрицательно заряженным атомом фтора соседней молекулы HF. Вследствие своих малых размеров атом водорода способен проникнуть в электронную оболочку соседнего атома фтора, вследствие чего и возникает водородная связь:
Это “проникновение“ свидетельствует о том, что вся полнота картины не может быть описана лишь электростатическим притяжением, в образование водородной связи вносит вклад и донорно-акцепторное взаимодействие.
Условием образования водородной связи является высокая электроотрицательность атома, связанного с атомом водорода. Только в таком случае электронное облако достаточно сильно смещается в сторону атома-партнера, и он приобретает высокий отрицательный заряд.
Энергия водородной связи невелика: она на порядок меньше энергии обычной ковалентной связи, но много выше энергии межмолекулярных взаимодействий. Несмотря на малую прочность, часто водородная связь определяет внутреннюю структуру вещества и существенно влияет на его физические и химические свойства. Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты:
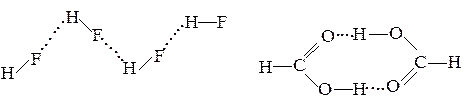 |
В кристалле льда каждый атом кислорода тетраэдрически связан с четырьмя атомами водорода: с двумя – полярной ковалентной связью (Н2О), а с двумя другими – водородной связью. В свою очередь, каждый атом водорода связан с двумя атомами кислорода.
Способностью к ассоциации обладают молекулы аммиака, спиртов, пероксида водорода, ряда кислот. Это приводит к повышению температур плавления и кипения, изменению взаимной растворимости. Ведь водородные связи могут образовываться и между двумя различными молекулами, например:
 Н Н
Н Н
Н – N + Н – О ® Н – N ××××××× Н – О
Н Н Н Н
Так, смешение спиртов с водой сопровождается разогреванием и уменьшением объема, что объясняют образованием водородных связей:
 |
СН3 – О + Н – О ® СН3 – О … Н – О
За счет водородных связей образованы такие сложные вещества как белки, углеводы, различные ферменты.
Водородная связь влияет и на химические свойства веществ. Например,
HF – слабая кислота, в отличие от других галогеноводородных кислот: диссоциация HF на ионы осложнена способностью ее к образованию дифторид-иона 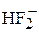 и других, более сложных частиц. Эти частицы столь прочны, что выделены кислые соли фтороводородной кислоты KHF2
и других, более сложных частиц. Эти частицы столь прочны, что выделены кислые соли фтороводородной кислоты KHF2
Кроме межмолекулярной, встречается и внутримолекулярная водородная связь, например:
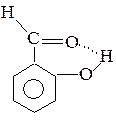 |
Характеристики связей разных типов приведены в таблице 2.
Таблица 2 - Характеристики связей
 Характе-
рстика
связи
Природа
связи Характе-
рстика
связи
Природа
связи
| Способ образования | Энергия (кДж/моль) | Длина (нм) | Полярность | Поляризуе- мость | Направленность | Насыщаемость |
| Ковалентная | обменный или донорно-акцепторный | 200 - 850 | 1-2×10-1 | полярна HCl неполярна Cl2 | поляризуема C-F< C-J | направлена | насыщаема |
| Ионная | электростатическое притяжение ионов | 80 - 130 | 2-3×10-1 | полярна | поляризуема | ненаправ- лена | ненасыщаема |
| Металлическая | объединение атомов и ионов свободными электронами | атомизация Nа-180 Cu-540 | многоцентровая | делокализована | – | ненаправ-лена | ненасыщаема |
| Водородная | взаимодействие атомов водороад с атомами F,O,N,Cl,S | 8 - 45 | 2,4-3,2×10-1 | полярна | поляризуема | направ-лена по линии Э-Н…Э | ненасыщаема |
1 ккал = 4,184 кДж; 1 нм = 10-9; 1нм = 10 
Дата добавления: 2014-12-20; просмотров: 2192;
