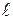Полряность связи
В двухатомных молекулах простых веществ, т.е. состоящих из атомов одного элемента (Н2, F2, N2, O2 и др.) область перекрывания электронных облаков располагается симметрично относительно ядер обоих атомов, на одинаковом расстоянии от них. Следовательно, центры положительных и отрицательных зарядов в молекуле совпадают, и такая связь называется неполярной.
Если же связь образована атомами различных элементов, электроотрицательность которых различается (но не очень резко), то область перекрывания электронных облаков взаимодействующих атомов обычно смещена в сторону одного из атомов (обладающего, большей электроотрицательностью). В таком случае связь называют полярной. Электронное облако тем больше смещается к электроотрицательному атому, чем сильнее различаются электроотрицательности элементов. При этом атом более электроотрицательного элемента несет избыточный отрицательный заряд, а его партнер – избыточный положительный заряд:
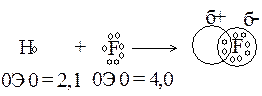 |
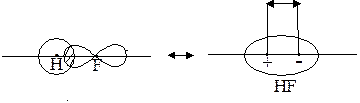
Следовательно, в молекуле с полярной связью центры положительных и отрицательных зарядов не совпадают. Такие системы называются электрическими диполями. Расстояние между центрами положительного и отрицательного зарядов ℓ называется длиной диполя (рисунок 6).
 |
|
Рис. 6. Диполь молекулы HF
Хотя суммарный заряд диполя равен нулю, из-за разделения зарядов в пространстве образуется электрическое поле, напряженность которого пропорциональна дипольному моменту молекулы.
Под дипольным моментом m понимают произведение абсолютного значения заряда электрона q на длину диполя ℓ:
m = q × ℓ.
Единица измерения дипольного момента – Дебай:
1Д = 3,33 × 10-30 КЛ × м.
Именно величиной дипольного момента и характеризуется степень полярности связи. Естественно, для неполярных молекул дипольный момент равен нулю (поскольку 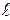 = 0). Для наиболее полярных молекул m ® 4.
= 0). Для наиболее полярных молекул m ® 4.
Следует различать полярность связи и полярность молекулы. В случае двухатомных молекул очевидно, что наличие полярной связи означает наличие диполя. В случае же многоатомных молекул в возникновении диполя играет роль и пространственное строение молекул.
Так, молекула оксида углерода (II) линейна:
О = С = О
Обе связи С = О полярны, причем дипольный момент каждой отдельной связи весьма значителен (mС=0 = 2,7 Д. Однако, вследствие симметричности молекулы, взаимная компенсация зарядов приводит к тому, что вся молекула оказывается неполярной: mС=0 = 0. Если же молекула нелинейна (например, Н2О, угол Н – О – Н около 1050), то дипольные моменты связей не компенсируются, и вся молекула представляет диполь (mС=0 = 1,84 Д).
Полярность молекул накладывает отпечаток на свойства веществ. Диполи ориентируются друг к другу разноименно заряженными полюсами, вследствие чего наблюдается взаимное притяжение между молекулами. Поэтому вещества, образованными полярными молекулами, обычно плавятся и кипят при более высоких температурах, чем неполярные вещества. Кроме того, полярность молекул сказывается и при растворении веществ в различных растворителях: вещество, состоящее из полярных молекул, лучше растворяется в полярном растворителе, и наоборот
Явление поляризации следует рассматривать как причину возникновения полярной связи. Рассмотрим суть этого явления.
В обычных условиях в неполярной молекуле центры положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке. При помещении такой молекулы в пространство между пластинами конденсатора заряды “расходятся“ – положительный смещается к отрицательно заряженной пластине и наоборот. Таким образом, возникает индуцированный диполь, характеризующийся величиной индуцированного дипольного момента mi.
Полярная молекула сама по себе представляет постоянный диполь. Под влиянием электрического поля, помимо ориентации по направлению поля, у молекулы дополнительно создается индуцированный дипольный момент, поскольку молекула “растягивается“ (деформируется). Результирующий дипольный момент mR складывается из постоянного и индуцированного:
mR = m + mi.
Явление возникновения диполя в неполярной молекуле (и увеличения диполя в полярной) одновременно с ориентацией диполей называется поляризацией.
p-связи поляризуются сильнее s-связей.
Очевидно, внешнее электрическое поле может быть обусловлено не обязательно приложением извне, а и воздействием других диполей, окружающих рассматриваемую молекулу.
Следует учитывать и взаимную поляризацию атомов, составляющих полярную молекулу, т.е. влияние их друг на друга, которое приводит к деформации электронных оболочек.
Величина поляризации зависит от поляризуемости атомов:
mi = Е × a,
где mi – индуцированный дипольный момент;
Е – напряженность электрического поля;
a – поляризуемость атомов (или ионов).
Таким образом, поляризуемость – это мера способности частицы (и, естественно, химической связи) к поляризации под действием электрического поля.
Способность к поляризации определяется радиусами атомов (ионов) и величиной относительной электроотрицательности.
Заметной деформации подвергается только внешняя электронная оболочка. Причем, чем слабее связаны внешние электроны с ядром, тем легче поляризуется атом (ион).
Поляризация ионов (а, следовательно, и связей) – процесс двусторонний, в котором сочетается поляризующее действие ионов с их поляризуемостью, причем на практике можно считаться только с поляризующим действием катионов и поляризуемостью анионов.
Поляризация ионов оказывает существенное влияние на свойства образуемых им соединений. Так, ион водорода, вследствие крайне малых размеров, обладает особенно высоким поляризующим действием. Отсутствие у него электронов позволяет сблизиться с анионом до очень малого расстояния. Это приводит, в частности, к тому. что многие кислоты по ряду свойств (устойчивость, диссоциация, окислительно-восстановительные свойства) сильно отличаются от свойств образуемых ими солей.
При изучении предыдущего вопроса было показано, что ковалентная химическая связь, за счет которой образуется большинство простых и сложных веществ, обладает большой прочностью, геометрической направленностью, насыщаемостью.
Эти характеристики отличают ковалентную связь от ионной химической связи, механизм образования которой несколько иной.
При рассмотрении ковалентной полярной связи указывалось. что она образуется между атомами элементов, обладающих различной, но не очень резко различающейся электроотрицательностью. В случае резкого различия в электроотрицательностях элементов говорят уже об ионной связи.
Таким образом, представления Льюиса являются более общими и ионную связь (по Косселю) можно рассматривать как ковалент ную, сильно полярную (см. ионная связь в LiF).
|
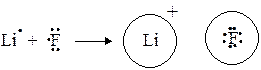 |
Электроотрицательности лития и фтора существенно различаются (1,0 и 4,0 соответственно), и образующаяся химическая связь становится настолько полярной, что электронная плотность в молекуле практически нацело смещается к атому фтора. Образуются два иона, связанные между собой силами электростатического притяжения
В отличие от ковалентной, ионная связь не обладает направленностью. Ионы можно представить как точечные заряды, создающие электрические поля, которые равномерно распределяются по всем направлениям. Это означает, что два разноименных заряда, образовавшие ионную связь, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ковалентным и ионным типами связи: ионная связь характеризуется ненасыщяемостью. Поэтому к иону может притягиваться различное число ионов противоположного знака. Это число ограничивается относительными размерами ионов. Кроме того, ионная связь несколько менее прочна, чем ковалентная, что позволяет ей легко разрушаться в полярных растворителях.
Отсутствие у ионной связи направленности и насыщаемости обусловливает склонность ионно построенных молекул к ассоциации. Лишь в газообразном состоянии (при высоких температурах) ионные молекулы существуют в виде мономеров. При обычных температурах в жидком, а, тем более, в твердом состоянии происходит объединение этих молекул и их взаимная ориентация с образованием ионной кристаллической решетки, в которой каждый ион окружен несколькими ионами противоположного знака. При этом все связи можно рассматривать как единую гигантскую молекулу. Сам же термин “молекула“ в применении к ионным соединениям следует понимать как условный, отражающий лишь элементарный состав вещества.
Возникает закономерный вопрос: какая должна быть разница в электроотрицательностях элементов, когда следует говорить уже не о ковалентной полярной, а об ионной химической связи? Оказывается, что полностью ионных соединений не существует, а, значит, нет и истинной ионной связи. Прежде всего, об этом свидетельствуют экспериментально измеренные (или “эффективные“) заряды атомов, из которых построены ионные соединения. Оказывается, что даже в соединениях, образованных самыми электроотрицательными и самыми электроположительными элементами связь не на 100% ионная. Так, эффективные заряды ионов CsF не равны заряду электрона, а составляют 0,93 от его величины. Эффективный заряд на атоме магния в MgCl2 не +2, а лишь +1,50, а алюминия в его оксиде вместо +3 только +1,77.
Неполное разделение зарядов в ионных соединениях объясняют взаимной поляризацией, которая приводит к деформации электронных оболочек ионов. Различные ионы поляризуются в различной степени, следовательно, можно говорить о большей или меньшей доле ионной связи. Идеальная ионная связь (передача электронов) – абстрактное понятие.
Однако принято говорить о степени ионности связей. Чем дальше отстоят два элемнта один от другого по значению электроотрицательности, тем сильнее выражена степень ионности связи между ними. При разнице в 1,7 ионность связи достигает 50%.
Таблица 1 – Соотношение между разностью электроотрицательностей
и степенью ионности связи
| ХА - ХБ | Степень ионности связи, % | ХА - ХБ | Степень ионности связей, % |
| 0,2 0,4 | 1,8 2,0 | ||
| 0,6 0,8 | 2,2 2,4 | ||
| 1,0 1,2 | 2,6 2,8 | ||
| 1,4 1,6 | 3,0 3,2 |
Таким образом, существенного различия между ковалентной и ионной связью нет: эти виды связи отличаются лишь степенью поляризации электронного облака.
Дата добавления: 2014-12-20; просмотров: 1880;