ВВЕДЕНИЕ. Свойства веществ зависят не только от состава, но и от типа химической связи между атомами.
Свойства веществ зависят не только от состава, но и от типа химической связи между атомами.
Химическая связь -взаимодействие между атомами в процессе образования веществ.
Вопрос о природе химической связи – один из основных в химии.
Первая попытка создания теории химической связи была предпринята в начале 19 века. Причина объединения атомов в молекулу – силы тяготения. Чем тяжелее атомы, тем прочнее связь Бергман (Швеция), Бертолле (Франция).
В 1810 г. появилась электрохимическая теория Я.Берцеллиус (Швеция). Каждый атом имеет два полюса (+) и (–), причем у одних атомов преобладает (+), у других – (–). Магний – электроположительный, кислород – электроотрицательный. Они притягиваются и образуют соединение – MgO. Если происходит только частичная компенсация зарядов, то продукт реакционноспособен и возможна следующая реакция:
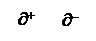 |
Мg + СО2 ® МgCO3
Эта теория существовала недолго, так как не объясняла существование прочных молекул Н2, Cl2 или интергалогенных соединений (JCl).
В 1852 году английский исследователь Франкланд ввел понятие валентности (атомности). Валентность выражает способность атома данного элемента вступать в соединение с определенным числом атомов другого элемента. Приняв валентность водорода за единицу, можно считать, что валентность других элементов является числом, показывающим, с каким числом атомов водорода (или другого одновалентного элемента) может соединяться атом данного элемента.
А.М.Бутлеров в 1861 году предложил теорию химического строения: соединение атомов происходит в соответствии с их валентностью и в определенном порядке. Определенный порядок атом в молекуле называется химическим строением.
Купер (Шотландия) в 1868 году отождествил одну валентность с одинарной химической связью, которую атом может образовать, вступая в химическое соединение. Предложено обозначать ее в виде валентного штриха.
Однако вопрос о силах, которые ответственны за образование валентных связей между атомами, оставался невыясненным.
Перейти к рассмотрению этой важнейшей проблемы химии удалось лишь после того, как было установлено, сложное строение атомов элементов и была создана теория строения их электронных оболочек.
Общие положения учения о химической связи.
Дата добавления: 2014-12-20; просмотров: 3093;
