Положение электронных облаков в пространстве.
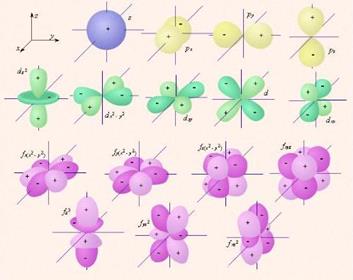


 s-орбиталь имеет одно положение в пространстве.
s-орбиталь имеет одно положение в пространстве.
| | |
| | |
p-орбиталь имеет три положения в пространстве.
d-орбиталь имеет пять положений в пространстве.
| | |
f-орбиталь имеет семь положений в пространстве.
| | |


 Правило 1: На одной орбитале может быть не более двух электронов и, обязательно, с противоположными спинами.
Правило 1: На одной орбитале может быть не более двух электронов и, обязательно, с противоположными спинами.
| ↑↓ |
s-орбиталь , максимум - 2e-
| ↑↓ | ↑↓ | ↑↓ |
p-орбиталь , максимум - 6e-
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
d-орбиталь , максимум - 10e-
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
f-орбиталь , максимум - 14e-
Обозначения:
- свободная орбиталь (без электронов),
| ↑ |
- орбиталь с неспаренным электроном,
| ↑↓ |
- орбиталь с электронной парой (с двумя электронами).
↑↑ нельзя ↑↑↑
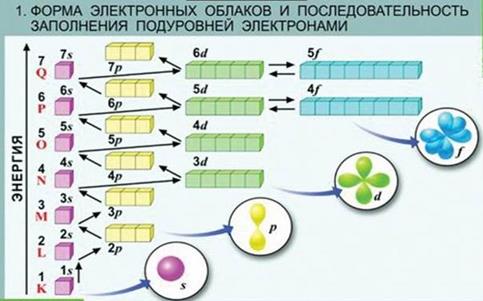
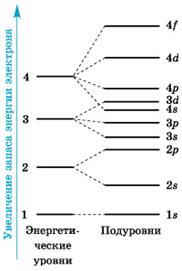
Состояние электронов в атоме: энергетические уровни и подуровни.
Одни электроны притягиваются к ядру с большей силой, поэтому располагаются ближе к ядру и имеют меньший запас энергии, а другие притягиваются с меньшей силой и располагаются дальше от ядра и имеют больший запас энергии.
Следовательно, электроны, имеющие приблизительно одинаковый энергию запаса располагаются на примерно одинаковом удалении от ядра, т.е. они составляют определённый энергетический уровень.
Но и на каждом энергетическом уровне электроны с примерно одинаковым запасом энергии имеют ещё и разной формы электронные облака (орбитали). Т.е. энергетические уровни подразделяют ещё и на энергетические подуровни: s-подуровень, p- подуровень, d- подуровень и f- подуровень.
Правило 2: Количество энергетических подуровней на уровне равно номеру данного энергетического уровня.
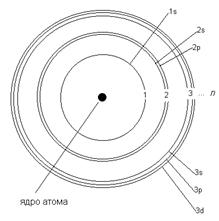
Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей. На каждом уровне и подуровне может помещаться только определенное количество электронов.
Энергии орбиталей одного подуровня одинаковы.
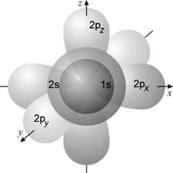
Рис. Орбитали атомов элементов, заполняющих свою внешнюю электронную оболочку на 2-м уровне. У таких атомов, как N, O, F и Ne электроны присутствуют на каждой из изображенных орбиталей.
Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы.
N = 2∙n2
Эта формула показывает максимальное число электронов (N) на определённом энергетическом уровне(n).
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.
РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ
| Энергетический уровень, значение n | Энергетический подуровень | Количество положений в пространстве электронных орбиталей | Максимальное число электронов на энергетических подуровнях | Максимальное число электронов на энергетических уровнях, 2n2 |
| s | ||||
| s | ||||
| p | ||||
| s | ||||
| p | ||||
| d | ||||
| s | ||||
| p | ||||
| d | ||||
| f |
Правила описания химических элементов по энергетическим уровням и подуровням.
1. Каждый уровень начинается с s-подуровня.
2. Количество подуровней на уровне равно номеру уровня.
3. На одной орбитали может быть не более двух электронов и обязательно с противоположными спинами.
4. Энергетический подуровень заполняется сначала электронами одного спина, пока на каждой орбитали энергетического подуровня не будет по одному электрону, лишь потом заполняются противоположными спинами.
5. p-подуровень заполняется на своём энергетическом уровне и заканчивает его.
6. d-подуровень начинает заполняться на следующем энергетическом уровне после s-подуровня данного энергетического уровня.
7. f-подуровень начинает заполняться через уровень после d-подуровня предыдущего уровня в таком порядке: сначала один электрон на d-подуровень, затем полностью заполняется f-подуровень и потом d-подуровень дозаполняется до конца.
8. Число электронов химического элемента соответствует порядковому номеру данного химического элемента (когда он электронейтрален).
9. s- и p-электроны составляют наружный энергетический уровень, а d- и f-электроны – внутренний энергетические уровень.
10. У d-элементов электроны могут переходить с s-подуровня на d-подуровень.
11. g-подуровень должен начинаться заполняться через два уровня.
12. j-подуровень должен начинаться через три уровня.
13. q-подуровень должен начинаться через четыре уровня.
Заполнение электронами энергетических подуровней и уровней с учетом энергии (по правилам):
 |  |  |  |  | |||||||||
 |  | ||||||||||||





 1s2 2s2 2p6 3s2 3p6 3d10 4s2 3d10 4p6 4d104f14 5s2 4d10 5p6 5d105f14 6s2 5d10 4f14 6p6 6d10 7s2 6d10 5f14
1s2 2s2 2p6 3s2 3p6 3d10 4s2 3d10 4p6 4d104f14 5s2 4d10 5p6 5d105f14 6s2 5d10 4f14 6p6 6d10 7s2 6d10 5f14
 |  | ||||
 |
1234567

П е р и о д
Т. е. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d10 4f14 6p6 7s2 6d10 5f14
Или
|
Вопросы: (для контроля знаний)
- Как формулировал периодический закон Д. И Менделеев и его современная формулировка? В чем отличие?
- Охарактеризуйте атом.
- Что образуется при изменении частиц атома? Дайте определение образующимся идам атома.
- Что такое орбиталь? Какие виды орбиталей выделяют? В чём между ними разница?
- Что такое энергетические уровни и подуровни?
- Какая электронная формула, какое имеется строение по энергетическим ячейкам, сколько электронов на внешнем энергетическом уровне у элемента:
а) 51Sb0;
б) 61Pm0;
в) 74W0.
Список используемых источников:
1. «Репетитор по химии» под редакцией А. С. Егорова; «Феникс», Ростов-на-Дону, 2006г.
2. http://www.1variant.ru/2011-10-27-22-57-07/51-2012-04-08-12-21-19/318-2012-08-10-21-59-47.html
3. http://onx.distant.ru/posobie-1/chemistry/part_4.htm
4. http://www.hemi.nsu.ru/ucheb145.htm
5. http://interneturok.ru/chemistry/11-klass/bstroenie-atoma-periodicheskij-zakonb/stroenie-atoma
6. http://www.hemi.nsu.ru/ucheb125.htm
7. http://www.hemi.nsu.ru/ucheb126.htm
Дата добавления: 2017-03-29; просмотров: 3824;
