Б. Объемная модель, показывающая расположение молекул воды, связанных водородными связями.
Энергия водородной связи Н---О в димере воды (H2O)2 составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
При температурах выше 0°С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рисунках 7-1а и 7-1б. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет примерно такую упорядоченную структуру, как на рис. 7-1б и 3-15 из §3.8.
Кстати, на этих рисунках хорошо видно, что в кристалле льда между молекулами остаются пустоты. Объем пустот чуть больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности. Большинство же других веществ, при замерзании, увеличивает свою плотность.
Таким образом, водородные связи придают воде еще одно уникальное свойство, без которого вряд ли могла бы существовать разнообразная жизнь в тех районах Земли, где температура зимой понижается ниже 0°С. Если бы лед тонул в воде, то зимой все водоемы промерзали бы до самого дна. Трудно ожидать, что рыбы согласились бы жить в таких условиях. Человек мог бы растапливать лед, превращая его в воду для своих нужд, но это потребовало бы огромных затрат дополнительной энергии.
РАСТВОРЫ
Введение. Способы выражения состава растворов.
Растворами называются такие системы, в которых одно вещество равномерно распределено в среде другого или других веществ. В общем случае этот термин может относиться к любому агрегатному состоянию системы. Сюда входят и смеси газов, и жидкие растворы, и твердые растворы или смешанные кристаллы.
Процесс растворения в общем случае отнюдь не представляет собой простого распределения молекул или ионов одного вещества среди молекул или ионов другого, но большей частью связан с различными взаимодействиями химического и физического характера между ними.
Когда речь идет о жидких растворах, то нередко пользуются понятиями растворителя и растворенного вещества. В случае растворов газов или твердых веществ в жидкостях растворителем считается обычно жидкость, а растворенным веществом— растворенный газ или твердое вещество, независимо от их относительного количественного содержания. В случае же растворов, жидкостей в жидкостях применение этих понятий не всегда целесообразно.
Когда компоненты обладают ограниченной смешиваемостью, то растворителем является тот из них, прибавление которого к раствору возможно в неограниченном количестве без нарушения гомогенности. Растворенным же веществом считается тот компонент, растворимость которого в данном растворе ограничена.
Если компоненты обладают неограниченной взаимной растворимостью, то можно выделить два случая. При значительном различии содержания компонентов в растворе растворителем называется обычно тот из них, который присутствует в относительно большем количестве, а остальные компоненты называются растворенными веществами. Так, при растворении небольшого количества спирта в большом количестве воды можно считать этот раствор раствором спирта в воде и называть воду растворителем, а спирт растворенным веществом. В обратном же случае, т. е. при растворении небольшого количества воды в большом количестве спирта, можно считать растворителем спирт, а воду растворенным веществом. В области промежуточных составов, когда различие в. относительном содержании компонентов невелико, применение этих понятий становится нецелесообразным и может привести к недоразумениям. Количественный состав растворов выражают различными способами. Широко распространено выражение его в массовых % или массовых долях. В физической химии чаще характеризуют его в мольных % или мольных долях, так как зависимость свойств растворов от состава обычно проще при выражении его соотношением мольных количеств компонентов.
Мольная доля Ni компонента iравна отношению числа молей ni этого компонента к сумме чисел молей (ni + n2 + nз+ … +nk)всех K компонентов раствора и определяется по формуле:
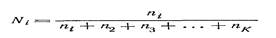
Мольную долю называют также молярной или молекулярной долей или дробью. Мольный процент равен 100 Ni.
Когда компонентами жидкого раствора являются жидкости или когда речь идет о газовых смесях, в некоторых случаях сопоставляют не весовые или мольные, а объемные количества компонентов; при этом выражают состав или в объемных долях, или в объемных процентах, или в объемных отношениях. Например, градусы крепости водно-спиртовых смесей выражают объемный процент спирта в растворе.
Объемная доля φi компонента i определяется по формуле:
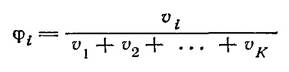

Когда концентрация выражается числом молей растворенного вещества в 1 л раствора, она называется молярностью.В некоторых случаях содержание растворенного вещества относят не к количеству раствора в целом, а к тому или иному количеству растворителя. Так, концентрация, выраженная числом молей растворенного вещества на 1000 г растворителя, называется моляльностью.
Дата добавления: 2019-07-26; просмотров: 645;
