Концентрация водородных ионов.
Вода в очень малой степени диссоциирует на ионы по уравнению
Н20 ===== Н+ + ОН-
Как известно водородные ионы Н+ всегда образуют в воде ионы гидроксония Н30+. Но, помня об этом, мы все же будем для простоты говорить, как обычно, о водородном ионе Н+, так как это не отразится на выводах.
В растворах, содержащих кислоты, образуемые ими водородные ионы влияют на положение равновесия в реакции (XIV, 12). В растворах, содержащих основания, на равновесие соответственно влияют гидроксильные ионы. Равновесие это определяется константой диссоциации, в общем случае выражаемой через активности:
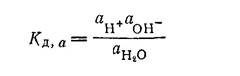
Для разбавленных растворов или для чистой воды активности могут быть заменены концентрациями:
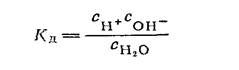
Равновесие в реакции диссоциации воды очень сильно смещено в сторону недиссоциированной воды, однако, устанавливается оно очень легко, и это делает реакцию (XIV, 12) весьма важной для многих свойств водных растворов. Так как степень диссоциации воды очень мала, то мы не внесем ощутимых искажений, если активность (или концентрацию) недиссоциированных молекул αН2О(Сн2о) примем постоянной и, объединяя ее с константой диссоциации, представим соотношения:
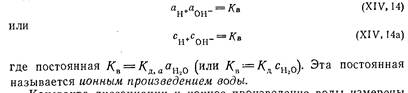
Константа диссоциации и ионное произведение воды измерены в настоящее время несколькими независимыми один от другого способами; результаты этих измерений хорошо согласуются.
При 25 °С ионное произведение воды КВ = 1,008 10-14, Так как в чистой воде, а также и в любой другой нейтральной среде
αн+ = αон- (или сН+ = сОН- ) то для 25оС αН+ = αОН- = √Кв = 1,004-7
грамм-ионов в литре и, следовательно, степень диссоциации
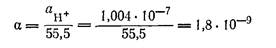
где 55,5 = сН2О, т. е. число молей воды в 1 л при 25 °С.
В ненейтральных средах активности αН+ и αОН- уже не равны между собой. Однако, как показывает равенство (XIV, 14), они в любых условиях связаны между собой, будучи обратно пропорциональными одна другой. Так, прибавляя к воде кислоту, мы повышаем концентрацию водородных ионов и, следовательно, повышаем αН+, но это усиливает обратное направление реакции (XIV, 12), и часть прибавленных Н+, связывая некоторое количество ОН- в молекулы Н20, понижает этим αОН-. Равновесие установится, когда произведение этих активностей ионов опять примет то же значение, что и до прибавления кислоты. Таким образом, любое повышение концентрации водородных ионов вызывает соответствующее уменьшение концентрации гидроксильных ионов, и наоборот.
Однозначность связи между этими величинами позволяет для характеристики как кислотности, так и щелочности сред пользоваться одной какой-нибудь из этих величин. Очевидно, они равноценны в этом отношении. Условились применять для этого активность водородных ионов.
В кислых средах αН+ больше, чем в чистой воде, и тем больше, чем выше кислотность, в щелочных же средах αН+ меньше, чем в чистой воде, и тем меньше, чем выше щелочность. Практически, однако, пользуются не самой величиной αН+, а так называемым водородным показателем рН, который определяется формулой:
рН = -lg αH+ и для разбавленных растворов рН = -lg cH+
Таким образом, водородным показателем называется величина, характеризующая активность (или концентрацию) водородных ионов и численно равная отрицательному десятичному логарифму этой активности (или концентрации, выраженной в грамм-ионах на литр).При 25 °С в нейтральной среде рН = 7, в кислых средах— меньше семи, и тем меньше, чем выше кислотность, а в щелочных средах — больше семи, и тем больше, чем выше щелочность (рис. 208).
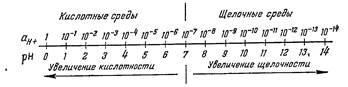
Не надо упускать из вида, однако, что эта характеристика нейтральности относится только к указанной температуре 25°С. Для всех температур справедливо, что в нейтральной среде αН+ = αОН-. Но реакция диссоциации воды (Н20 = Н+ + ОН-) эндотермическая (Q = —13600 кал/моль), поэтому с повышением температуры равновесие в ней смещается вправо, т. е. степень диссоциации воды возрастает. Следовательно, в любом данном растворе концентрации и активности ионов и водорода и гидроксила при более высоких температурах будут больше, чем при 25 °С, а при более низких — меньше. В частности, в нейтральной среде при 0°С рН = 7,97, а при 100 °С рН = 6,12.
Рассмотренные соотношения лежат в основе общей теории кислот, оснований и индикаторов в водной среде. Концентрация водородных ионов играет большую роль в целом ряде самых различных явлений и процессов — в жизнедеятельности растительных и животных организмов и организма человека, в производственных процессах пищевой, кожевенной, текстильной и многих других отраслей промышленности; она сильно влияет на свойства природных вод и на возможность применения их для той или другой цели.
Лекция 2
Буферные растворы
На практике нередко возникает необходимость иметь раствор с устойчивым водородным показателем, не изменяющимся сильно от тех или других воздействий. Буферными растворами называются растворы с устойчивой концентрацией водородных ионов и, следовательно, с определенным рН, почти не зависящим от разведения и лишь слабо изменяющимся при прибавлении к раствору небольших количеств сильной кислоты и щелочи. Такими свойствами обладают растворы, содержащие слабую кислоту или слабое основание совместно с их солью. Рассмотрим для примера раствор, содержащий уксусную кислоту и ацетат натрия СН3СОONа. Равновесие в процессе диссоциации кислоты характеризуется константой диссоциации:
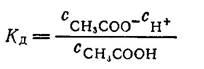
Присутствие ацетата натрия, который диссоциирует в сильной степени, настолько увеличивает концентрацию ионов СН3СОО-, что диссоциация самой кислоты подавляется практически почти полностью. Поэтому в выражении (а) сСНзСООН — концентрацию недиссоциированных молекул кислоты — можно заменить общей концентрацией уксусной кислоты в растворе Скисл. Концентрация же ацетатных ионов сСНзСОО- практически равна α Ссоли — произведению концентрации соли в растворе на степень диссоциации ее. В результате получаем:
н+ = 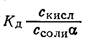
причем для разбавленных растворов можно принять α = 1.
Это соотношение показывает, что сН+ зависит главным образом от отношения концентраций соли и кислоты. Поэтому разбавление раствора почти не отражается на сН+.И действительно, одновременное понижение концентраций кислоты и соли от 0,1 н. до 0,001 н. изменяет рН раствора с 4,63 всего до 4,73 (это ничтожное изменение рН обусловлено некоторым изменением степени диссоциации соли).
Прибавление небольших количеств сильной кислоты или щелочи тоже сравнительно слабо отражается на рН. Это объясняется тем, что при прибавлении кислоты ее ионы Н+ связываются с ацетатными ионами соли в недиссоциированные молекулы уксусной кислоты, а если прибавляется щелочь, то она связывается уксусной кислотой в соответствующий ацетат.
БУФЕРНЫЕ СМЕСИ
Растворы, которые обладают свойством поддерживать в определенных границах постоянной величину рН при добавлении к ним сильных кислот, щелочей, а также при разбавлении, называются буферными. Буферные растворы представляют собой чаще всего растворы слабой кислоты и хорошо диссоциированной соли этой кислоты (сильного электролита) или раствора слабого основания и его хорошо диссоциированной соли. Для выяснения механизма буферного действия рассмотрим в качестве примера буферную смесь, состоящую из слабой уксусной кислоты и ацетата натрия — сильного, практически полностью диссоциированного электролита:
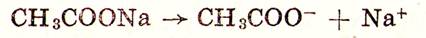
Уксусная кислота малодиссоциирована (константа диссоциации ее равна 1,75•10-5 ):
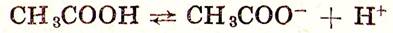
Практически вся кислота в таком растворе будет находиться в молекулярной форме, а все ионы СН3СОО- образуются в растворе благодаря диссоциации СН3СООNа.
Если к такому раствору добавлять соляную кислоту, то ионы водорода свяжутся с анионами СН3СОО- в молекулу СН3СООНи концентрация Н+ практически не изменится. Если к этому раствору добавлять гидроксид натрия, ионы ОН- будут связываться с ионами Н+, образуя молекулу воды. Это вызовет сдвиг равновесия диссоциации уксусной кислоты вправо, в результате чего полностью восстановится исходная концентрация ионов Н+. Это и будет проявлением буферного действия.
Буферными свойствами обладают также и растворы многих органических веществ, в частности аминокислоты, несущие как кислотную функцию (карбоксигруппы), так и основную функцию (аминогруппы). В связи с большой основностью аминогруппы и высокой кислотностью карбоксигруппы оказывается возможным внутримолекулярный перенос протона по реакции:
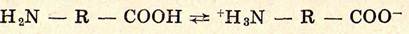
с образованием биполярных или так называемых цвиттер-ионов. Полное равновесие диссоциации аминокислот может быть представлено схемой:
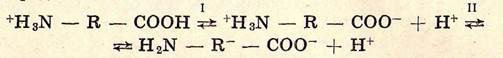
В кислой области при рН < 6,1 доминирует равновесие I с кислотой +Н3N — R — СООН и сопряженным основанием +Н3N — — R — СОО-, а в основной при рН > 6,1 — равновесие II с кислотой +Н3N — R — СОО-и сопряженным основанием Н2N — R — СОО-. Каждая из этих кислотно-основных пар обладает высокими буферными свойствами в области рН = 2,4 (I) и рН = 9,7 (II).
Буферные смеси играют большую роль в физиологических процессах. Так, во время работы мышц образуется молочная, масляная и ацетоуксусная кислоты, которые частично попадают в ткани и кровь и могли бы изменить величину рН крови и тканей, вызывая нарушение физиологических процессов. Наличие буферных смесей в живом организме (Nа2НРО4/NаН2РО4; NаНСО3/Н2СО3) препятствует изменению в нем рН. Буферные смеси широко используют в химической технологии.
Для количественной характеристики буферных, свойств введена величина, которая названа буферной емкостью (β). Она равна количеству эквивалентов кислоты (а) или щелочи (b), которое необходимо добавить к 1 л буферного раствора, чтобы изменить рН раствора на единицу
Дата добавления: 2019-07-26; просмотров: 1507;
