Водородкарбонатная (гидро-, бикарбонатная) буферная система
Бикарбонатнаябуферная система– мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
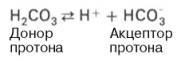
Для данной буферной системы величину рН в растворе можно выразить через константу диссоциации угольной кислоты (рКН2СО3) и логарифм концентрации недиссоциированных молекул Н2СО3 и ионов HCO3–:
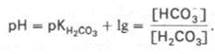
НСО3-/Н2СО3 плазмы крови характеризуется равновесием молекул слабой угольной кислоты Н2СО3 с образующимися при ее диссоциации гидрокарбонат-ионами НСО3-(сопряженное основание):
НСО3-+ Н+ →Н2СО3
НСО3-+ Н2О →Н2СО3 + ОН-
В организме угольная кислота возникает в результате гидратации диоксида углерода - продукта окисления углеводов, белков и жиров. Причем процесс этот ускоряется под действием фермента карбоангидразы:
СО2(р) + Н2О → Н2СО3
Равновесная молярная концентрация в растворе свободного диоксида углерода при 298, 15 К в 400 раз выше, чем концентрация угольной кислоты Н2СО3/ СО2 = 0, 00258.
Между СО2 в альвеолах и водородкарбонатным буфером в плазме крови, протекающей через капилляры легких, устанавливается цепочка равновесий:
Атмосфера →СО2(г) →СО2(р) → Н2СО3 →Н+ + НСО3-
воздушное пространство легких → Н2О →плазма крови
В соответствии с уравнение Гендерсона-Гассельбаха рН водордкарбонатного буфера определяется отношением концентрации кислоты Н2СО3 и соли NaНСО3.
Согласно цепочке равновесий содержание Н2СО3 определяется концентрацией растворенного СО2, которая пропорциональна парциальному давлению СО2 в газовой фазе (по закону Генри): СО2р = Кгр(СО2). В конечно счете оказывается, что с (Н2СО3) пропорциональна р(СО2).
Водородкарбонатная буферная система действует как эффективный физиологический буферный раствор вблизи рН 7,4.
При поступлении в кровь кислот - доноров Н+ равновесие в цепочке по принципу Ле Шателе смещается влево в результате того, что ионы НСО3-связывают ионы Н+ в молекулы Н2СО3. При этом концентрация Н2СО3 повышается, а концентрация ионов НСО3- соответственно понижается. Повышение концентрации Н2СО3, в свою очередь, приводит к смещению равновесия 2 влево. Это вызывает распад Н2СО3 и увеличении концентрации СО2, растворенного в плазме. В результате смещается равновесие 1 влево и повышается давление СО2 в легких. Избыток СО2 выводится из организма.
При поступлении в кровь оснований - акцепторов Н+ сдвиг равновесий в цепочке происходит в обратной последовательности.
В результате описанных процессов водородкарбонатная система крови быстро приходит в равновесие с СО2 в альвеолах и эффективно обеспечивает поддержание постоянства рН плазы крови.
Вследствие того, что концентрация NaНСО3 в крови значительно превышает концентрацию Н2СО3, буферная емкость этой системы будет значительно выше по кислоте. Иначе говоря, водокарбонатная буферная система особенно эффективно компенсирует действие веществ, увеличивающих кислотност крови. К числу таких веществ, прежде всего, относят молочную кислоту HLac, избыток которой образуется в результате интенсивной физической нагрузки. Этот избыток нейтрализуется в следующей цепочке реакций:
NaНСО3+ HLac → NaLac + Н2СО3 →Н2О + СО2(р) →СО2(г)
Таким образом, эффективно поддерживается нормальное значение рН крови при слабо выраженном сдвиге рН, обусловленным ацидозом.
В замкнутых помещениях часто испытывают удушье - нехватку кислорода, учащение дыхания. Однако удушье связано не столько с недостатком кислорода, сколько с избытком СО2. Избыток СО2 в атмосфере приводит к дополнительному растворению СО2 в крови (согласно закону Генри), а это приводит к понижению рН крови, т. е. к ацидозу (уменьшение резервной щелочности).
Водородкарбонатная буферная система наиболее "быстро" отзывается на изменение рН крови. Ее буферная емкость по кислоте составляет Вк = 40 ммоль/л плазмы крови, а буферная емкость по щелочи значительно меньше и равна примерно Вщ = 1 - 2 ммоль/л плазмы крови.
2. Фосфатная буферная система НРО42-/Н2РО4- состоит из слабой кислоты Н2РО4-и сопряженного основания НРО42-.
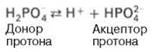
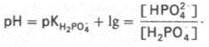
В основе ее действия лежит кислотно-основное равновесие, равновесие между гидрофофсфат- и дигидрофосфат-ионами:
НРО42- + Н+ →Н2РО4-
НРО42-+ Н2О → Н2РО4- + ОН-
Фосфатная буферная система способа сопротивляться изменению рН в интервале 6,2 - 8,2, т. е. обеспечивает значительную долю буферной емкости крови.
Фосфорная буферная система имеет более высокую емкость по кислоте, чем по щелочи. Поэтому она эффективно нейтрализует кислые метаболиты, поступающие в кровь, например молочную кислоту HLac:
НРО42- + HLac →Н2РО4- + Lac-
Однако различия буферной емкости данной системы по кислоте и щелочи не столь велики, как у водородкарбонатной: Вк = 1 - 2 ммоль/ л; Вщ = 0, 5 ммоль/ л. Поэтому фосфатная система в нейтрализации как кислых, так и основных продуктов метаболизма в связи с малым содержанием фосфатов в плазе крови менее мощная, чем вородкарбонатная буферная система.
3. Буферная система оксигемоглобин-гемоглобин, на долю которой приходится около 75% буферной емкости крови, характеризующаяся равновесием между ионами гемоглобина Hb- и самим гемоглобином HНb, являющимся очень слабой кислотой (КHНb = 6, 3 10-9; рКHНb = 8, 2).
Hb-+ Н+ → HНb
Hb- + Н2О →HНb + ОН-
а также между ионами оксигемоглобина HbО2- и самим оксигемоглобином HНbО2, который является несколько более сильной, чем гемоглобин, кислотой (КHНbО2 = 1. 12 10-7; рКHНbО2 = 6, 95):
HbО2- + Н+ →HНbО2
HbО2- + Н2О →HНbО2 + ОН-
Гемоглобин HНb, присоединяя кислород, образует оксигемоглобин HНbО2 HНb + О2 HНbО2 и, таким образом, первые два равновесия взаимосвязаны со следующими двумя.
4. Белковая буферная система состоит из "белка-основания" и "белка-соли".
белок-основание → белок-соль
Соответствующее кислотно-основное равновесие в средах, близких к нейтральным, смещено влево и "белок-основание" преобладает.
Основную часть белков плазмы крови (90%) составляют альбумины и глобулины. Изоэлектрические точки этих белков (число катионных и анионных групп одинаково, заряд молекулы белка равен нулю) лежат в слабокислой среде при рН 4,9 - 6,3, поэтому в физиологических условиях при рН 7,4 белки находятся преимущественно в формах "белок-основание" и "белок-соль".
Буферная емкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протон-акцепторных групп. Эта система может нейтрализовать как кислые, так и основные продукты. Однако вследствие преобладания формы "белок-основание" ее буферная емкость значительно выше по кислоте и составляет для альбуминов Вк = 10 ммоль/л, а для глобулинов Вк = 3 ммоль/л.
Буферная емкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связано с тем, что почти все аминокислоты имеют значения рКа, очень далекие от рКа = 7. Поэтому при физиологическом значении рН их мощность мала. Практически только одна аминокислота - гистидин (рКа = 6,0) обладает значительным буферным действием при значениях рН, близких к рН плазмы крови.
Таким образом, мощность буферных систем плазмы крови уменьшается в направлении
НСО3-/ Н2СО3 → белки → НРО42-/ Н2РО4 → аминокислоты
Эритроциты. Во внутренней среде эритроцитов в норме поддерживается постоянное рН, равное 7,25. Здесь также действуют водородкарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах белковая система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболической СО2), так и в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом. Необходимо отметит, что эта буферная система в эритроцитах тесно связана с водородкарбонатной системой. Т. к. рН внутри эритроцитов 7,25, то соотношение концентраций соли (НСО3-) и кислоты (Н2СО3) здесь несколько меньше, чем в плазме крови. И хотя буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН.
Фосфатная буферная емкость играет в клетках крови гораздо более важную роль, чем в плазме крови. Прежде всего, это связано с большим содержанием в эритроцитах неорганических фосфатов. Кроме того, большое значение в поддерживании постоянства рН имеют эфиры фосфорных кислот, главным образом фосфолипиды, составляющие основу мембран эритроцитов.
Фосфолипиды являются относительно слабыми кислотами. Значения рКа диссоциации фосфатных групп находятся в пределах от 6,8 до 7,2. Поэтому при физиологическом рН 7,25 фосфолипиды мембран эритроцитов находятся как в виде неионизированных, так ионизированных форм. Иначе говоря, в виде слабой кислоты и ее соли. При этом соотношение концентраций соли и слабой кислоты составляет примерно (1,5 - 4). Следовательно, сама мембрана эритроцитов обладает буферным действием, поддерживая постоянство рН внутренней среды эритроцитов.
Таким образом, в поддержании постоянства кислотно-щелочного равновесия в крови участвует ряд буферных систем, обеспечивающих кислотно-основной гомеостаз в организме.
Нарушения кислотно-щелочного равновесия. В тех случаях, когда компенсаторные механизмы организма не могут предотвратить нарушения К.-щ. р., развиваются два патологических состояния, противоположных по своей направленности:Ацидоз и Алкалоз. При ацидозе концентрация ионов Н+ выше нормы; при этом рН крови ниже нормы. При уменьшении концентрации ионов Н+ и соответственном повышении значения рН крови развивается алкалоз. Состояния, при которых рН ниже 6,8 и выше 8,0, не совместимы с жизнью. Однако на практике такие значения рН крови, как 6,8 и 8,0, не наблюдаются.
Ацидоз и алкалоз могут возникнуть вследствие различных причин, но в основном к нарушению К.-щ. р. приводят три патологических процесса: нарушение выведения углекислого газа легкими, избыточное образование кислых продуктов в тканях и нарушение выведения из организма оснований с мочой, потом и др. Однако на практике простые формы расстройства К.-щ. р. встречаются реже, чем комбинированные, обусловленные воздействием различных факторов.
Лекция 3
Диффузия и осмос
Как известно, при температуре выше абсолютного нуля все молекулы находятся в постоянном беспорядочном движении. Это показывает, что они обладают определенной кинетической энергией. Благодаря постоянному движению при смешении двух жидкостей или двух газов их молекулы равномерно распределяются по всему доступному объему.
Диффузия — это процесс, ведущий к равномерному распределению молекул растворенного вещества и растворителя.Как всякое движение, диффузия требует энергии. Диффузия всегда направлена от большей концентрации данного вещества к меньшей, от системы, обладающей большей свободной энергией, к системе с меньшей свободной энергией. Свободной энергией называется часть внутренней энергии системы, которая может быть превращена в работу. Свободная энергия, отнесенная к 1 молю вещества, носит название химического потенциала. Таким образом, химический потенциал — это мера энергии, которую данное вещество использует на реакции или движение. Химический потенциал — функция концентрации. Скорость диффузии зависит от температуры, природы вещества и разности концентраций. Чем выше концентрация данного вещества, тем выше его активность и его химический потенциал. Диффузионное передвижение вещества всегда идет от большего к меньшему химическому потенциалу. Наибольший химический потенциал у чистой воды. (Почему?) Добавление к воде молекул растворенного вещества приводит к возникновению связи между молекулами воды и растворенного вещества, что уменьшает ее активность, ее свободную энергию, ее химический потенциал. В том случае, если диффундирующие вещества встречают на своем пути мембрану, движение замедляется, а в некоторых случаях прекращается. Диффузия воды по направлению от своего большего к меньшему химическому потенциалу через мембрану носит название осмоса. Иначе говоря, осмос — это диффузия воды или другого растворителя через полупроницаемую перепонку, вызванная разностью концентраций или разностью химических потенциалов.
Дата добавления: 2019-07-26; просмотров: 904;
