РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Гипотеза электролитической диссоциации. Вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, называются электролитами. В 1805 г. литовский ученый Ф. X. Гроттус, излагая свою теорию электролиза, высказал мнение, что частицы растворенных веществ состоят из положительной и отрицательной частей и под действием электрического поля закономерно ориентируются.
Согласно гипотезе электролитической диссоциации молекулы солей, кислот и оснований при растворении их в воде претерпевают диссоциацию на соответствующие ионы.
Ионизаия электролитов при растворении. Причины электролитической диссоциации. В молекулах или в кристаллах соединений с ионной связью содержатся не нейтральные атомы элементов, а их ионы, и, например, хлористый натрий состоит из ионов Nа+ и С1- не только в водных растворах, но и в любом его состоянии. Из этих ионов состоят, в частности, и кристалл поваренной соли и молекулы NаС1 в парах. Таким образом, в отношении ионных соединений развитие электронной теории валентности избавило гипотезу электролитической диссоциации от задачи объяснить процесс образования ионов, так как при растворении такого электролита происходит лишь разъединение ионов, а не образование их. Переход ионов в раствор происходит в результате взаимодействия их с молекулами растворителя, в результате образования связей между ионом и молекулами растворителя (сольватация ионов) и, в частном случае, молекулами воды (гидратация ионов).

Под действием электрических полей, создаваемых ионами электролита, полярные молекулы растворителя, например воды, притягиваются ионами, ориентируются около них (рис. 205) и в свою очередь, притягивая ионы к себе, ослабляют этим связь между ними. Подобным же образом они действуют и на ионы, составляющие решетку ионного кристалла, при растворении его в воде (рис. 206).
Однако этим дело не ограничивается. Если диссоциация протекает в растворителях, молекулы которых способны к образованию водородных и донорно-акцепторных связей, то этот вид взаимодействия молекул растворителя с частицами электролита может существенно влиять на ход процесса. Так, в растворителях с высокой диссоциирующей способностью (Н20, НF) именно такое взаимодействие играет часто основную роль в процессе диссоциации.
Как мы видели, связь через водородный атом образуется атомами наиболее электроотрицательных элементов. Молекулы воды обладают способностью к образованию водородной связи не только между собой, но и с другими молекулами, содержащими атомы сильно электроотрицательных элементов. При таком взаимодействии молекулы воды могут через свой водородный атом связываться с наиболее отрицательными атомами других молекул или, наоборот, связываться с водородным атомом другой молекулы, если он несет достаточно высокий положительный заряд, усиливая этим полярность его связи с молекулой. В последнем случае молекула воды может оттянуть к себе этот водород в виде положительного иона, образуя ион гидроксония Н3О+. Именно благодаря такому взаимодействию вода обладает способностью вызывать сильную диссоциацию некоторых веществ, кристаллизующихся в молекулярных, а не в ионных решетках (например, НС1). Поэтому в этиловом спирте хлористый водород диссоциирует в сильной степени, а в динитробензоле в очень слабой, хотя диэлектрические проницаемости этих растворителей различаются лишь незначительно.
Сильные и слабые электролиты. Свойства растворов слабых электролитов. По способности к диссоциации электролиты разделяются на сильные и слабые.
К сильнымпринадлежат сильные кислоты, сильные основания и большая часть солей. Сюда относятся не только соли, образованные сильным основанием или сильной кислотой, но большей частью и соли, образованные слабым основанием и слабой кислотой. Большинство сильных электролитов кристаллизуется в кристаллах с ионной решеткой, и сильными электролитами часто называют только такие вещества.
К слабым электролитам принадлежат в первую очередь слабые кислоты и слабые основания, а также некоторые соли. Сюда относятся большинство органических кислот, фенолы, амины, некоторые неорганические основания и кислоты (угольная, синильная), а также такие соли, как хлорная ртуть, цианистая ртуть и др.
По современным представлениям сильные электролиты в растворах различной концентрации (для некоторых электролитов — кроме очень высокой) практически полностью диссоциированы на ионы.
Процесс диссоциации слабых электролитов является обратимым, так как ионы противоположного знака, встречаясь в растворе, могут вновь соединяться в молекулы. Для электролита вида В2А процесс диссоциации представляется уравнением
В2А ==== 2В+ + А2-
Как и во всяком обратимом процессе, здесь устанавливается некоторое равновесие. Количество его можно характеризовать константой равновесия (константой диссоциации Кд), определяемой для разбавленных растворов того же электролита В2А обычным соотношением:
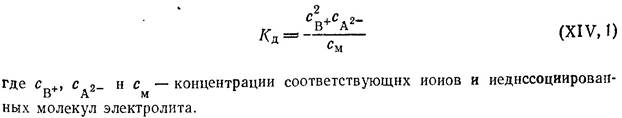
Для характеристики состояния слабого электролита в растворе наряду с константой диссоциации пользуются также и величиной степени диссоциации а, которая определяется отношением:

Константа диссоциации является величиной, свойственной данному электролиту. При постоянной температуре в одном и том же растворителе она должна быть величиной постоянной. Степень же диссоциации характеризует состояние электролита в растворе только данной концентрации и меняется с ее изменением, с уменьшением концентрации она возрастает, приближаясь к единице. Наоборот, с повышением концентрации вероятность взаимной встречи ионов в растворе и их воссоединения в недиссоциированные молекулы возрастает. Поэтому при повышении концентрации степень диссоциации обычно уменьшается.
Дата добавления: 2019-07-26; просмотров: 557;
