Периодический закон Менделеева Дмитрия Ивановича. Строения атома.
К середине XIX в. – периода завершения второго химико-аналитического этапа развития химии – было открыто уже более 60 элементов, у большинства которых были изучены физические и химические свойства (некоторые из элементов к этому времени не были выделены еще в чистом виде). 
Открытие новых элементов и изучение свойств элементов и их соединений, с одной стороны, позволили накопить большой фактический материал, а с другой – выявили необходимость его систематизации. Первыми попытками систематизации элементов следует, по-видимому, считать установление их общих групповых свойств. Так, наиболее резко выраженный основный характер был обнаружен у соединений элементов, названных щелочными металлами, а способность к проявлению кислотных свойств – у соединений галогенов.
Кроме того, для многих элементов были получены количественные характеристики, определяющие их свойства. Среди них наибольший интерес представляли относительная атомная масса элементов и их валентность, т.е. способность к образованию различных форм соединений.
Ни одна из попыток классифицировать химические элементы не выявила основной закономерности в их расположении и, следовательно, не могла привести к созданию естественной системы, охватывающей все химические элементы и отражающей природу их сходства и различия. Решение этой задачи оказалось доступно лишь нашему соотечественнику Д. И. Менделееву.
В отличие от всех своих предшественников русский учёный сопоставил между собой несходные элементы, расположив все известные элементы в порядке возрастания атомных масс. Ниже приведены первые 14 элементов этой последовательности:
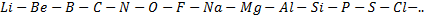
При переходе от K к F происходит закономерное ослабление металлических свойств и усиление неметаллических с одновременным увеличением валентности. Переход от фтора от F к следующему по значению атомной массы элементу натрию Na сопровождается скачкообразным изменением свойств и валентности, причем натрий во многом повторяет свойства лития, будучи типичным одновалентным металлом, хотя и более активным. Следующий за натрием магний Mg во многом сходен с бериллием Be (оба двухвалентны, проявляют металлические свойства, но химическая активность обоих выражена слабее, чем у пары Li – Na). Алюминий Al, следующий за магнием, напоминает бор B (валентность равна 3). Как близкие родственники похожи кремний Si и углерод C, фосфор P и азот N, сера S и кислород O, хлор Cl и фтор F. При переходе к следующему за хлором в последовательности увеличения атомной массы элементу калию K опять происходит скачок в изменении валентности и химических свойств. Калий, подобно литию и натрию, открывает ряд элементов (третий по счёту), представители которого показывают глубокую аналогию с элементами первых двух рядов.
Таким образом, в естественном ряду элементов (т.е. элементов, расположенных в порядке возрастания атомной массы) их химические свойства изменяются не монотонно, а периодически. Закономерное изменение свойств элементов в пределах одного отрезка естественного ряда Li – F повторяются и у других (Na – Cl, K – Br). Иначе говоря, сходные в химическом отношении элементы встречаются в естественном ряду через правильные интервалы и, следовательно, повторяются периодически. Эта замечательная закономерность, обнаруженная Д. И. Менделеевым и названная им законом периодичности, была сформулирована следующим образом:
Свойства простых тел, а также форма и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Принципиальная новизна Периодического закона, открытого и сформулированного Д. И. Менделеевым спустя ровно три года, заключалась в следующем:
Устанавливалась связь между НЕСХОДНЫМИ по своим свойствам элементами. Эта связь заключается в том, что свойства элементов плавно и примерно одинаково изменяются с возрастанием их атомного веса, а затем эти изменения ПЕРИОДИЧЕСКИ ПОВТОРЯЮТСЯ.
В тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались ПРОБЕЛЫ, которые надо было заполнить еще не открытыми элементами. Мало того, Периодический закон позволял ПРЕДСКАЗЫВАТЬ свойства этих элементов.
Открытый закон периодичности Д. И. Менделеев использовал для создания периодической системы элементов. «Днем рождения» системы Д. И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д. И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов. В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым.
Закон периодичности и периодическая система элементов сыграли важную конструктивную роль при проверке и уточнении свойств многих элементов.
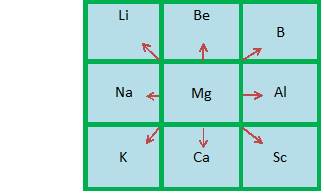
Предсказывая свойства неизвестных элементов, Д. И. Менделеев использовал вытекавшее из периодического закона правило звездности, в соответствии с которым свойства любого химического элемента, например, Mg, находятся в закономерной связи со свойствами соседних элементов, расположенных по горизонтали (Na, Al), вертикали (Be, Ca) и диагонали (Li, Sc и K, B).
Спустя несколько лет шведский ученый Л. Нильсон открыл предсказанный Д.И. Менделеевым экабор, назвав его скандием. Наконец, в 1886 г. немецкий химик К. Винклер открыл новы элемент – германий, свойства которого полностью совпали со свойствами, указанными Д. И. Менделеевым для экасицилия. После этого периодический закон получил всемирное признание, а периодическая система стала неотъемлимой частью любого учебника по химии.
Периодический закон – величайшее достижение химической науки, основа всей современной химии. С его открытием химия перестала быть описательной наукой, в ней стало возможным научное предвидение.
Более детальное изучение строения вещества показало, что периодичность свойств элементов обусловлена не атомной массой, а электронным строением атомов.
Заряд ядра является характеристикой, определяющей электронное строение атомов, а следовательно, и свойства элементов. Поэтому в современной формулировке Периодический закон звучит так:
Дата добавления: 2017-03-29; просмотров: 606;
