Характеристика атома
1. Атом состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов, а электронная оболочка – из электронов. Радиус ядра примерно в 100000 раз меньше радиуса атома.
2. Так как масса электрона незначительна по сравнению с массами протона и нейтрона, то ею можно пренебречь, то есть масса атома (называется массовым числом) сосредоточена в ядре:
 m ат= mp + mn + me
m ат= mp + mn + me
3. Ядро заряжено положительно за счёт протонов.
4. Электроны заряжено отрицательно, вращаются вокруг ядра и вокруг своей оси по «часовой стрелки» или против «часовой стрелки». Движение электрона вокруг своей оси называется «спин».
5. Число протонов равно числу электронов, поэтому атом будет электронейтрален. Атом из периодической таблицы – всегда электронейтрален.
6. Число протонов соответствует порядковому номеру элемента в таблице ПСХЭ (Периодической системе химических элементов).
7. Число нейтронов: nn = m ат – np (масса атома минус число протонов).
 Fe 26
Железо Fe 26
Железо
 55,8 55,8
|
Порядковый номер
Относительная масса
5626Fe (26р+; 30n0) 26e-
При изменении числа протонов образуется другой химический элемент.
Химический элемент– это вид атома с одинаковым числом протонов, т.е. с одинаковым зарядом ядра.
При изменении числа нейтронов элемент не изменяется, а изменяется его масса и образуется изотоп.
Изотопы – это разновидности атома данного химического элемента, различающиеся массой атома, т.е атомы с одинаковым числом протонов, но разным числом нейтронов.
Например, элемент водород имеет три изотопа: протий (11H), дейтерий (12H) и тритий (13H). Первые два существуют в природе, тритий получен искусственным путем. Подавляющее большинство химических элементов имеет разное число природных изотопов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента, которая приводится в периодической системе, – это средняя величина массовых чисел природных изотопов данного элемента с учетом процентного содержания каждого из этих изотопов. Химические свойства всех изотопов одного химического элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
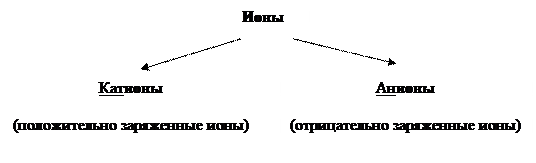
При изменении числа электронов ни элемент, ни его масса не изменяется, а изменяется заряд атома и образуются ионы.
Ионы – это заряженные разновидности атомов данного химического элемента, у которых одинаковое число протонов, но разное число электронов.
 |
Задача.
 Что получим, если в цинке +1p+, -3n0, -2e-?
Что получим, если в цинке +1p+, -3n0, -2e-?
| 6530Zn0 | 30 p+ 35 n0 30 e- | +1p+ -3n0 -2e- | 31 p+ 32 n0 28 e- | 6331Ga+3 | 6931Ga0 |
Катион изотопа галлия
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель позволяет объяснить многие экспериментальные факты, например, почему при химических реакциях тепло или выделяется, или поглощается – из-за перехода электрона с уровня на уровень. Данная модель строения атома получила названия «модель Бора».
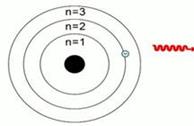
Квантовая механика представила более современную модель строения атома.
В настоящее время согласно современным квантово-механическим представлениям электроны обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом (электрон одновременно – это и частица, и волна) и при вращении образуют различной формы электронные облака.
Движение электрона в атоме.
Согласно квантовой механике, область пространства в электронном облаке, в которой вероятность нахождения электрона наибольшая, называется орбиталью.
Формы электронных облаков:
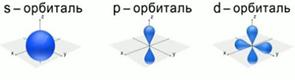
f-орбиталь имеет более сложную форму.
1. s-форма электронного облака (s – «sharp» - резкая, отчётливая) (s-орбиталь) – «шарообразного» вида.
2. p форма электронного облака (p – «principal» - главная) (p-орбиталь) – вида «объёмной симметричной восьмерки».
3. d-форма электронного облака (d – «diffuse» - диффузная, размытая) (d-орбиталь) – вида «простого цветка».
4. f-форма электронного облака (f – «fundamental» - основная) (f-орбиталь) – вида «сложного цветка».
Дата добавления: 2017-03-29; просмотров: 7351;
