МОНОМолекулярные реакции с точки зрения ТАС.
Теория Линдемана.
В элементарном акте мономолекулярной реакции участвует всего одна молекула. В соответствии с теорией активных столкновений реакция начинается со встречи двух активных молекул. Количество столкновений пропорционально квадрату концентраций. Поэтому, казалось бы, что мономолекулярные реакции, как и бимолекулярные, должны иметь порядок, равный двум. Но многие мономолекулярные реакции описываются уравнением первого порядка, причем порядок реакции может изменяться при изменении концентрации (давления) и быть дробным.
Объяснение механизмов газовых мономолекулярных реакций дано Линдеманом. Он предположил, что после столкновения активные молекулы могут не только распадаться на продукты реакции, но и дезактивироваться. Механизм реакции представляется двухстадийным:
1) A+A 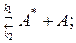
2) 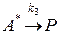
A 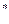 – активная молекула.
– активная молекула.
На первом этапе происходит перераспределение энергии, в результате чего одна молекула становится активной, а другая дезактивируется.
На второй стадии оставшиеся активные молекулы мономолекулярно превращаются в продукты реакции.
Рассмотрим стационарный процесс:
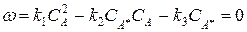
Выразим концентрацию активной частицы А*: 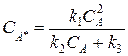 . Подставим это выражение в выражение скорость определяющей стадии (вторая стадия):
. Подставим это выражение в выражение скорость определяющей стадии (вторая стадия):
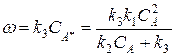 уравнение Линдемана
уравнение Линдемана
Анализ уравнения Линдемана:
1. СА – очень маленькая. В этом случае промежутки между столкновениями молекул настолько велики, что дезактивация происходит редко. Распад активных молекул на продукты происходит без затруднений; лимитирующей стадией является стадия активации. В связи с этим в уравнении Линдемана пренебрегаем в знаменателе 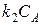 относительно k3 (
относительно k3 ( 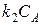 << k3).
<< k3).
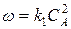 ; n=2 (второй порядок реакции)
; n=2 (второй порядок реакции)
2. СА – очень большая. В этом случае лимитирующей стадией является стадия вторая, мономолекулярная. Затрудненность этой стадии объясняется тем, что активные молекулы часто теряют избыточную энергию при столкновении и не успевают образовывать продукты реакции. Тогда в уравнении Линдемана в знаменателе можно пренебречь k3 относительно 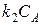 (
( 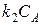 >>k3).
>>k3).
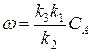 ; n=1 (реакция первого порядка)
; n=1 (реакция первого порядка)
3. СА – средняя. В этом случае мономолекулярные реакции могут иметь дробный порядок (1<n<2).
Дата добавления: 2019-10-16; просмотров: 845;
