Вывод уравнения ТАС.
Теории химической кинетики. Теория активных столкновений (ТАС).
Основные предпосылки:
1. Молекулы представляют в виде шариков.
2. Для того, чтобы произошло взаимодействие, необходимо столкновение.
3. Процесс протекает только в том случае, если энергия столкновения больше или равна определенному значению энергии, которая называется энергией активации.
В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.
Вывод уравнения ТАС.
z – общее число столкновений в единицу времени.
z= 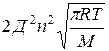
Д – эффективный диаметр молекул;
n – число молекул в единице объема;
M – молекулярная масса.
С помощью закона Больцмана определяем количество активных столкновений z 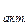 , т.е. таких, в которых энергия превышает энергию активации:
, т.е. таких, в которых энергия превышает энергию активации:
z 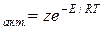
Тогда доля активных столкновений составит:
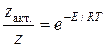
Рассмотрим бимолекулярную газовую реакцию типа: 2А 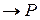 , где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
, где Р – продукты реакции. Например, это может быть разложение йодистого водорода:
2HJ 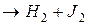
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
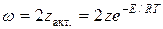 или
или
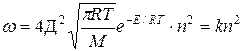 (
( 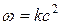 )
)
Отсюда видно, что скорость реакции зависит от квадрата концентрации.
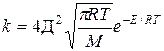
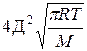 = k
= k 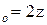
k=k 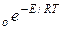 уравнение Аррениуса
уравнение Аррениуса
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k 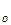 , который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени.
В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде:
k=z 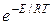 уравнение Аррениуса
уравнение Аррениуса
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р.
Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом:
k = pz 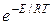
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул.
В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации.
Е 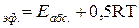
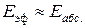
Факты, которые не объясняет ТАС:
1. Не дает метода теоретического расчета энергии активации.
2. Не объясняет протекания в растворах.
3. Не объясняет природы стерического фактора.
Дата добавления: 2019-10-16; просмотров: 808;
