Вывод основного уравнения ТАК.
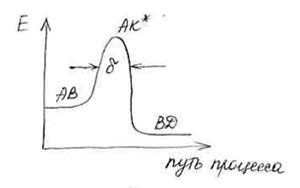
Скорость процесса определяется скоростью прохождения активированным комплексом расстояния 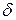 .
.
Обозначим:
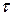 – время жизни активированного комплекса.
– время жизни активированного комплекса.
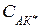 – концентрация активированного комплекса.
– концентрация активированного комплекса.
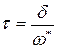 , где
, где 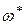 – средняя скорость прохождения АК через барьер.
– средняя скорость прохождения АК через барьер.
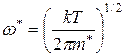 , где
, где
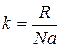 – константа Больцмана;
– константа Больцмана;
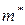 – масса комплекса; Т – температура, К.
– масса комплекса; Т – температура, К.
Тогда время жизни комплекса равно:
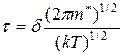
Скорость процесса:  . Подставим в это выражение значение времени жизни комплекса
. Подставим в это выражение значение времени жизни комплекса 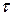 :
:
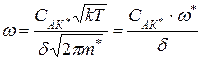 – скорость реакции.
– скорость реакции.
В уравнение вводится трансмиссионный коэффициент 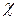 , показывающий, какая доля активированных комплексов переходит в продукты реакции.
, показывающий, какая доля активированных комплексов переходит в продукты реакции.
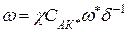
Рассмотрим бимолекулярную реакцию с позиции ТАК:
А+В  АВ
АВ 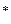 → АВ
→ АВ
Скорость процесса описывается кинетическим уравнением второго порядка:  .
.
Выразим константу скорости:
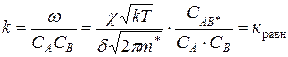 – выражение константы равновесия.
– выражение константы равновесия.
Константу равновесия процесса образования продуктов реакции и исходных веществ можно представить следующим образом:
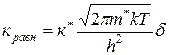 , где
, где
к* – константа равновесия процесса образования активированного комплекса;
h – постоянная Планка.
Подставим это выражение в выражение константы скорости бимолекулярной реакции:
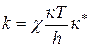 уравнение Эйринга
уравнение Эйринга
Это уравнение позволяет связать кинетические параметры с термодинамическими.
1. Вводится понятие теплоты и энтропии активации.
2. С помощью этого уравнения можно рассчитать абсолютные скорости химического процесса.
Дата добавления: 2019-10-16; просмотров: 1083;
