ПРАВИЛО ВАНТ-ГОФФА. УРАВНЕНИЕ АРРЕНИУСА.
Температурная зависимость для простых реакций выражается правилом Вант-Гоффа.
Правило Вант-Гоффа:для простых гомогенных реакций при увеличении температуры на 100С скорость химической реакции возрастает в 2 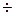 4 раза.
4 раза.
Выражается это следующей формулой:
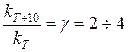
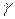 – температурный коэффициент Вант-Гоффа.
– температурный коэффициент Вант-Гоффа.
Правило Вант-Гоффа в случае изменения температуры более чем на 100С выражается формулой:
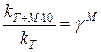 ,
,
где М – коэффициент, кратный 10.
Более того зависимость скорости реакции от температуры определяется уравнением Аррениуса:
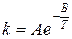
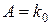 – предэкспоненциальный множитель.
– предэкспоненциальный множитель.
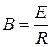 ,гдеR – универсальная газовая постоянная, Е – энергия активации.
,гдеR – универсальная газовая постоянная, Е – энергия активации.
Тогда получим следующее выражение:
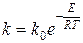 уравнение Аррениуса
уравнение Аррениуса
Энергия активации – это минимальная энергия, которой должны обладать молекулы для взаимодействия.
Для реакции АВ+С → АС+В изменение энергии вдоль пути реакции можно представить следующим образом:
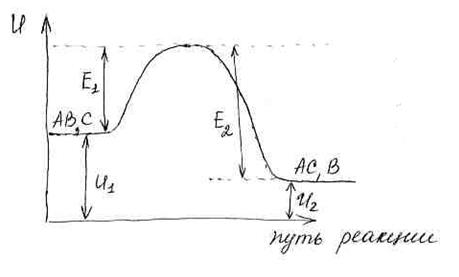
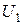 – внутренняя энергия исходных веществ;
– внутренняя энергия исходных веществ;
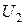 – внутренняя энергия продуктов реакции;
– внутренняя энергия продуктов реакции;
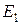 – энергия активации прямой реакции;
– энергия активации прямой реакции;
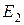 – энергия активации обратной реакции.
– энергия активации обратной реакции.
С увеличением температуры изменяется не энергия активации процесса, а увеличивается потенциальная энергия самих молекул.
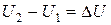 тепловой эффект процесса.
тепловой эффект процесса.
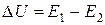
Дата добавления: 2019-10-16; просмотров: 705;
