Раздел №6. Термодинамические условия проведения реакций синтеза макромолекул (продолжение предыдущей лекции)
Внедрение гетероатомов в систему цикла атомов углерода мало влияет на общую термодинамическую картину, но активирует реакцию раскрытия циклов.
Трехчленные гетероциклы легко вступают в реакции полимеризации.
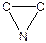
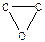
Четырехчленные гетероциклы также способны вступать в реакции полимеризации.
Пятичленные гетероциклы труднее вступают в реакции полимеризации (появляются термодинамические ограничения).
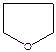 -тетрагидрофуран
-тетрагидрофуран 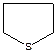 - тетрагидротиофен
- тетрагидротиофен
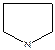 - тетрагидропиррол
- тетрагидропиррол
Шестичленные гетероциклы не способны вступать в реакции полимеризации.
Семичленные гетероциклы легко вступают в реакции полимеризации:
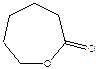 ε - капролактон
ε - капролактон
(также способен полимеризоваться: Qпол = -ΔH= -3.3 ккал/моль, ΔS = -2.5 энт. ед, Тпред ≈ 1300К).
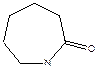 - капролактам
- капролактам
(способен полимеризоваться: Qпол = -ΔH = 3,3 ккал/моль, ΔS = -4 энт. ед, Тпред ≈ 830К).
Более крупные циклы с включением гетероатомов легко полимеризуются:
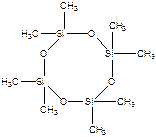 - гексаметилциклооктасилоксан
- гексаметилциклооктасилоксан
(легко полимеризуется: Qпол = -ΔH = -1,5 ккал/моль, ΔS = 46 энт. ед, полимеризация разрешена во всей области температур).
Термодинамически возможная степень превращения мономера в полимер рассчитывается по формуле:
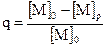 , (6.1)
, (6.1)
где [M]p – равновесная концентрация мономера, [M]0 – начальная концентрация мономера
Если [M]p=[M]0, то мономер полимеризоваться не будет; если [M]p >[M]0, то реакция не пойдет образующийся полимер будет термодинамически нестабильным.
Итак, выяснено, что существует область, в которой возможно протекание реакции, которая ограничивается предельными температурами (верхней или нижней). Следует также учесть, что мономеры и полимеры могут находиться в разных фазовых состояниях, это будет также влиять на термодинамические ограничения. Помимо этого полимеризация может проводиться в растворе, это также влияет на диапазон температур, в котором может проводиться полимеризация.
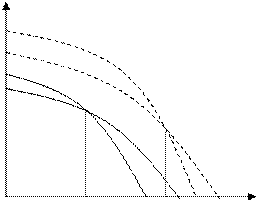 Μ
Μ
Мж
Пж
(Мж)р
(Пж)р
Тпр (в р-ре) Тпрр (в массе) Т
Рис. 6.1. Зависимость термодинамического потенциала от температуры при растворении
При растворении термодинамические потенциалы как мономера, так и полимера понижаются (самопроизвольные процессы). При этом точка пересечения кривых μ = f(T), т.е. Тпр может понизиться.
Влияние различных факторов на возможность протекания полимеризации:
1) Влияние давления на протекание полимеризации определяется зависимостью:
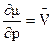 , (6.2)
, (6.2)
где 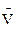 - парциальный мольный объем
- парциальный мольный объем
Рассматривая эту зависимость для мономера и полимера, можно получить зависимость предельной температуры от давления, которая имеет вид (аналог уравнения Клаперона-Клаузиуса):
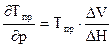 (6.3)
(6.3)
Где ∆V– разность объемов мономера и полимера , ∆Н – разность соответствующих энтальпий.
Таким образом, изменяя давление, можно изменить значение предельной температуры. Однако, требуется значительное изменение давления, чтобы существенно изменить предельную температуру.
В случае α-метилстирола при переходе от давления в 1 до 6500 бар Тпр возрастает от 61 ◦С до 170 ◦С.
2) Влияние кристаллизации полимера:
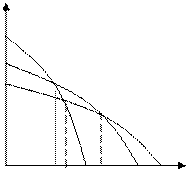 Μ
Μ
М
Пам
Пкр
Тпр Тпркр Тппл Т
Рис. 6.2. Зависимость термодинамического потенциала от температуры при кристаллизации полимера
При кристаллизации изменение энтропии отрицательно и в соответствии со схемой Тпр повышается. Благодаря этому фактору удается осуществлять полимеризацию формальдегида при умеренных температурах, т. к. образующийся полиформальдегид кристаллизуется.
Для определения величин ΔHпол и ΔSпол можно использовать различные приемы, простейший путь основан на измерениях равновесной концентрация мономера в зависимости от предельной температуры:
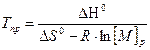 , (6.4)
, (6.4)
откуда 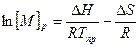 (6.5)
(6.5)
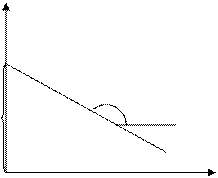 |
ln[M]p
-ΔS/R
ΔH/R
1/Tпр
Рис. 6.3. Зависимость ln[M]p от 1/Tпр
Таким образом, из зависимости ln[M]p от 1/Tпр можно определить величины ∆Нпол и ∆Sпол.
Дата добавления: 2019-07-26; просмотров: 335;
