Термодинамика поликонденсации
В процессе поликонденсации происходит химическое взаимодействие низкомолекулярных молекул a-R-b (группы a и b взаимодействуют между собой), приводящее к образованию удлиненных цепочек, т.е. к образованию олигомерных или полимерных молекул. Кроме того, могут образовываться циклы. Процесс поликонденсации часто происходит с выделением низкомолекулярного продукта (w).
Реакцию поликонденсации можно записать в виде:
 n a-R-b a-(R-X)n-1-R-b + (n-1)w
n a-R-b a-(R-X)n-1-R-b + (n-1)w
Поликонденсация может также быть бимолекулярной, когда конденсируются молекулы типа a-R-a или b-R-b.
Правило Ругли-Циглера:
Если процесс поликонденсации протекает при повышенных концентрациях мономера, то образуются линейные полимеры; при малых концентрациях мономера образуются циклы.
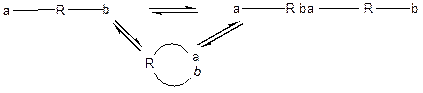
При достижении равновесного превращения мономера, состояние систем можно рассматривать как равновесие: линейный продукт↔циклический продукт конденсации (т.е. полимеризационное равновесие цикл – цепь). При этом равновесное содержание циклических форм можно определить как qцикл= [M]равн/[M]0. С уменьшением [M]0 qцикл растет и стремиться к 1 при [M]0→[M]равн.
Рассмотрим поликонденсацию с образованием линейных цепей:
 a-R-b + a-R-b a-R-ba-R-b + w
a-R-b + a-R-b a-R-ba-R-b + w
 M2 + a-R-b M3 + w
M2 + a-R-b M3 + w
………………………………….
 Mn-1 + a-R-b Mn + W
Mn-1 + a-R-b Mn + W
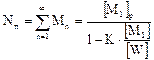 (6.1.1)
(6.1.1)
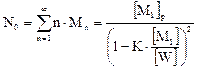 (6.1.2)
(6.1.2)
Получаем:
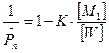 , (6.1.3)
, (6.1.3)
если n>>1, то 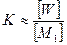 (6.1.4)
(6.1.4)
В это уравнение также как и в уравнение для полимеризационно-деполимеризационного равновесия входят концентрации только низкомолекулярных веществ, а концентрация полимера не входит. Характер равновесия процесса поликонденсации - квазигетерогенный.
Химия образования макромолекул
 - имеется молекула с кратной связью, рассмотрим возможные пути активации для ее раскрытия.
- имеется молекула с кратной связью, рассмотрим возможные пути активации для ее раскрытия.
Пути активации:
1. активация с помощью свободных радикалов:
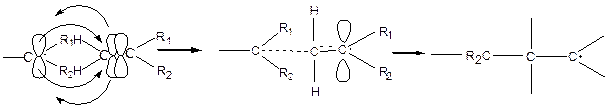 |
образуется промежуточный квазиаллильный радикал
На рисунке 6.1.1. изображена зависимость потенциальной энергии от расстояния: 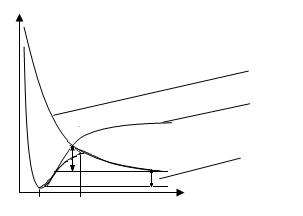
U
- кривая отталкивания
- кривая притяжения
Еа - Qпол (тепловой эффект)
r0 r* r
Рис. 6.1.1. Зависимость потенциальной энергии от расстояния
Еа – энергия, необходимая для образования переходного состояния («квазиаллильного» радикала) – энергия активации, r* - переходный комплекс.
2. активация с помощью карбкатиона:
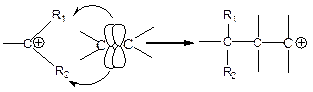
3. активация с помощью карбаниона:
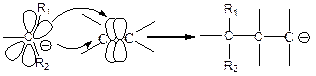
Итак, получаем, что существует 3 типа воздействия на кратную связь:
· воздействие свободных радикалов (радикальная полимеризация);
· воздействие катионов (катионная полимеризация);
· воздействие анионов (анионная полимеризация).
Вопросы для самостоятельной проработки:
- Как влияет наличие гетероатома в циклах, состоящих из атомов углерода, на реакцию полимеризации?
- Как рассчитывается термодинамически возможная степень превращения полимера в мономер?
- Какие существуют факторы, влияющие на возможность протекания полимеризации?
- В чем заключается правило Ругли-Циглера для процесса поликонденсации?
- Какие пути образования макромолекул известны в настоящее время?
Задачи для самостоятельного решения
3. Методы получения и структура основных типов полимеров
3.2. Термодинамика полимеризации
Вопросы 2501 – 2505, 2406 – 2409, 2310 – 2313
Дата добавления: 2019-07-26; просмотров: 580;
