Диаграммы состояния однокомпонентных систем 2 страница
Горизонтальная линия, проведенная при температуре Т2 от линии ликвидуса до вертикали выпадающей твердой фазы, носит название конноды.
При достижении температуры эвтектики состав расплава становится равным Lm и начинается дополнительная кристаллизация компонента А. В системе будут находиться уже три фазы: расплав, кристаллы А и В. Степень свободы при этом становится равной нулю. Таким образом, точка эвтектики на диаграмме определяет нонвариантное состояние. Дальнейшее понижение температуры невозможно без изменения числа равновесных фаз. Поэтому в точке эвтектики закончится кристаллизация исходного состава системы, а пропадающей фазой при этом будет расплав. По окончании кристаллизации система становится моновариантной, и дальнейшее понижение температуры приводит к охлаждению смеси кристаллов А и В.
Фазовые изменения любого другого бинарного состава системы будут протекать аналогично рассмотренному. Исключение составляет исходный состав, совпадающий с точкой эвтектики. Для него при температуре Те начинается одновременная кристаллизация компонентов А и В и при этой же температуре кристаллизации закончится.
Фазовые изменения исходного состава системы М или его путь кристаллизации удобно представить в виде (табл.).
В таблице запись Lm- > е следует понимать так: состав расплава меняется от точки М к точке е. Для определения состава расплава, как и любой другой точки системы из искомой точки опускается перпендикуляр на ось концентраций: точка пересечения этих прямых
Таблица – фазовые изменения системы при охлаждении
| Температура | Равновесные фазы | Степень свободы |
| Т = То | Lm | |
| Т = Т1 | Lm + кр.В | |
| Те < Т < Т1 | Lm- > е + кр.В | |
| Т = Те | Lе + кр.А +кр.В | |
| Т < Те | кр.А + кр.В |
определяет соотношение компонентов в расплаве.
Для упрощения записей в дальнейшем по тексту лекций мы не будем употреблять для записи кристаллической фазы сокращение [кр.], а только наименование компонента (А или В) или химического соединения, например АВ.
Правило рычага
По диаграммам равновесия двухкомпонентных систем можно определять не только качественно фазовые равновесия, но и рассчитывать количественное соотношение равновесных фаз.
Для этого используется правило рычага: если одна фаза в системе распадается на две, то количество образовавшихся фаз обратно пропорционально отрезкам, заключенным между точкой исходного состава и точками составов образовавшихся фаз.
Покажем работу правила на примере. Пусть Q – масса исходного расплава состава М (рис.18). При охлаждении исходного состава до температуры Т2 выделилось некоторое количество кристаллов компонента В. Обозначим это количество кристаллов через Х.
В исходном расплаве при температуре выше Т1 количество компонента А определяется как
А = (Q*FB) / 100
При температуре Т2 количество компонента А в расплаве определяется как
А = (Q – X)*DB / 100.
Учитывая, что при кристаллизации исходного расплава до температуры Т2 количество компонента А не изменялось, мы вправе записать
(Q*FB) / 100 = (Q – X)*DB / 100
Из последнего уравнения имеем количество кристаллов как
X = Q*(DB – FB) / DB = (Q*DB) / DB
и количество расплава
Q – X = (Q*FB) / DB.
Отношение равновесных фаз при температуре Т2 (кристаллов к расплаву) будет определяться следующим образом:
X / (Q – X) = (Q*DF*DB) / (DB*Q*FB) = DF / FB.
Таким образом, отрезок DB определяет общее количество равновесных фаз, отрезок DF – количество кристаллической фазы, FB – количество оставшегося в системе расплава.
Для практического использования правила рычага при решении задач фазового равновесия необходимо за 100% принять отрезок, ограниченный составами равновесных в данных условиях фаз. Точка исходного состава будет обязательно находиться на этом отрезке и делить его в пропорциях, соответствующих равновесным фазам.
Построение диаграмм состояния
Построение равновесных диаграмм основано на изучении количества и состава фаз при различных температурах. Для таких целей используют два метода: динамический (метод кривых охлаждений) и статический (метод закалки).
Суть динамического метода заключается в построении кривых охлаждения (нагревания) для исходных составов системы в координатах ²температура-время² при постоянной скорости изменения температуры. При этом с помощью специального оборудования обнаруживаются тепловые эффекты, вызываемые физико-химическими процессами, происходящими в системе: полиморфные превращения, химические реакции, кристаллизация и плавление, разложение соединений системы.
Построение диаграммы равновесия двухкомпонентной системы А-В заключается в анализе кривых охлаждения (рис.19). Для этого составляют смеси компонентов А и В при их различном соотношении и нагревают навеску до полного ее плавления. Получаемый расплав выдерживается для достижения полной гомогенизации, а затем охлаждается с постоянной скоростью и фиксированием температуры смеси во времени.
Если рассматривается точка, содержащая 100% компонента (кривые А или В), то на кривой охлаждения появляется горизонтальная площадка кристаллизации, температура которой соответствует температуре кристаллизации данного компонента. Число степеней свободы при этом равно 0, то есть пока не изменится число фаз (в равновесии находятся одновременно расплав компонента и его кристаллы) температура системы изменяться не может. Если мы рассматриваем процесс охлаждения системы, то после окончания кристаллизации (расплав пропадает) в равновесии будет находиться только одна фаза – кристаллы, и температура навески начнет понижаться. На диаграмму находятся соответственно точки кристаллизации компонентов А и В на вертикалях, соответствующих 100% содержанию каждого из них (ta и tв).
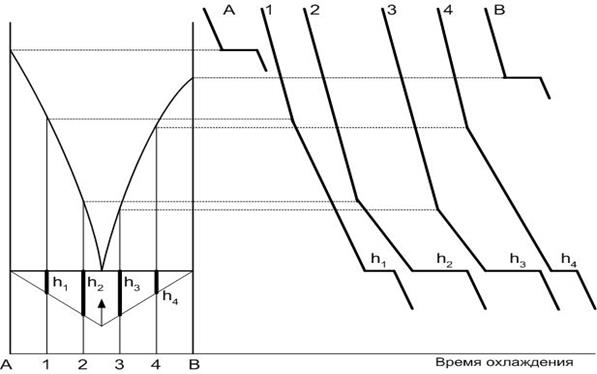
Рис.19. Построение диаграмм равновесия по кривым охлаждения
Если охлаждается смесь компонентов (например, состав 1, в котором содержание компонента А = 80%, а компонента В = 20%), то при какой-то температуре расплав становится перенасыщенным по отношению к одному из них. Начинается кристаллизация компонента (в нашем примере компонента А). Так как процесс кристаллизации носит экзотермический характер, то выделяющееся при этом тепло уменьшает скорость охлаждения системы и на кривой охлаждения это фиксируется появлением угла наклона.
Точка перегиба проецируется на вертикаль исходного состава диаграммы. Аналогично наносятся другие точки составов, принадлежащие кривым ликвидуса диаграммы.
Для всех смесей при температуре эвтектики появляется площадка кристаллизации, когда происходит кристаллизация расплава эвтектического состава. Величина горизонтальной площадки, соответствующей этому процессу, будет зависеть от исходного состава системы и будет максимальна для состава Е. Указанное выше положено в основу построения треугольника Таммана для определения точного положения некоторых точек диаграммы. В нашем случае перпендикулярно эвтектической горизонтали для каждого состава системы откладывается длина горизонтальных площадок h1, h2, h3, h4, через концы которых проводят прямые линии. Их взаимное пересечение указывает на точное положение эвтектического состава системы.
Анализ кривых охлаждения позволяет установить также положение на диаграмме линий полиморфного превращения, химических соединений, точек эвтектики и перитектики.
Для силикатных систем, скорость установления равновесного состояния в которых невелика, динамический метод дает не всегда корректный результат. В этом случае пользуются статическим методом: гомогенизированную смесь компонентов нагревают до заданной температуры, выдерживают длительное время при этой температуре, а затем резко охлаждают. Затем методами химического анализа проводят определение состава и количества образовавшихся фаз. Эта процедура для одного состава многократно повторяется при изменении температуры выдержки и по полученным результатам строят диаграмму равновесия. Метод отличается высокой точностью, но большей, чем в динамическом методе, трудоемкостью.
5.6.4. Диаграмма состояния двухкомпонентной системы с химическими соединениями
Зачастую между компонентами системы наблюдается химическое взаимодействие с образованием химических соединений. Рассмотрим такие типы диаграмм. На рис.20 представлены диаграммы равновесия со всеми типами химических соединений: плавящимися конгруентно (без разложения) – AmBn, инконгруентно (с разложением) – АВ и разлагающимся в твердой фазе – ApBq.
Составы химических соединений на диаграмме показываются сплошными вертикальными линиями, проведенными из точки соотношения компонентов в химических соединениях.
Так как соединение AmBn плавится конгруентно, то состав его соответствует составу расплава, получаемого при плавлении соединения, то есть линия состава химического соединения обязательно доходит до линии ликвидуса при температуре плавления химического соединения. Диаграмма по линии соединения AmBn делится на две части, каждая из которых представляет собой отдельную диаграмму. В этом смысле никаких отклонений в кристаллизации исходных составов системы от ранее рассмотренных не будет. Если исходный состав системы соответствует составу химического соединения, то кристаллизация его начнется и закончится при температуре
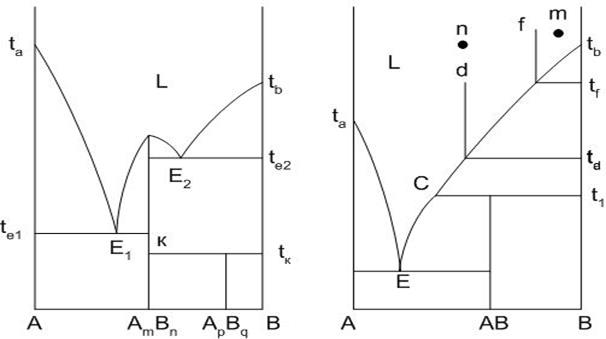
Рис.20. Диаграммы равновесия двухкомпонентных систем с химическими соединениями
плавления химического соединения AmBn (как для отдельного компонента).
Вертикальная линия состава химического соединения ApBq, разлагающегося в твердой фазе при нагревании доходит до горизонтальной линии к – tk, проведенной при температуре разложения ApBq. Концы линии указывают на составы образующихся при разложении химического соединения ApBq фаз (точка к – кристаллы химического соединения AmBn, точка tк – кристаллы компонента В).
Отличительной особенностью диаграммы с химическим соединением, плавящимся инконгруентно, является то, что вертикаль состава химического соединения АВ не доходит до линии ликвидуса E-C-tв. При температуре Т1 при нагревании химическое соединение плавится с разложением на расплав состава Lc и кристаллы компонента В, при этом состав расплава не соответствует составу химического соединения (точка состава расплава С и вертикаль химического соединения не совпадают).
Точка С на диаграмме – точка перитектики. Эта точка, в которой начинается и протекает химическая реакция взаимодействия ранее выделившегося в кристаллическом состоянии компонента В и расплава Lc с образованием химического соединения АВ: кр.В + Lc = AB. В точке перитектики в равновесии находятся одновременно три фазы, определяющиеся нонвариантное состояние системы. Пока одна из фаз не исчезнет, температура изменяться не может. Какая фаза пропадает в результате протекания химической реакции, зависит от точки исходного состава системы. Если исходный состав системы содержит компонента В больше, чем его находится в химическом соединении АВ (точка М на рис.20), то в результате протекания химической реакции в точке перитектики пропадет расплав, в равновесии останутся две кристаллические фазы: АВ и В. Если исходный состав системы содержит компонента В меньше, чем его находится в химическом соединении АВ (точка N на рис.20), то в результате протекания химической реакции в точке перитектики пропадет компонент В, в равновесии останутся расплав состава С и АВ. И в том случае, когда в исходном составе системы количество компонента В совпадает с его количеством в химическом соединении, то в результате протекания химической реакции в точке перитектики пропадут как В, так и расплав: в равновесии останутся только кристаллы химического соединения АВ. Пути кристаллизации исходных составов системы приведены в табл.6.
Таким образом, кристаллизация исходных составов системы может закончиться как в точке эвтектики, так и в точке перитектики.
Таблица 6
| Температура | Равновесные фазы | Примечание |
| Состав а: | ||
| T > Ta | La | |
| T = Ta | La + кр.В | |
| T1 < T < Ta | La→c + кр.В | |
| T = T1 | Lc + кр.В = AB | Начало химической реакции, в резуль- тате которой исчезает В |
| T < T1 | Lc + AB | |
| и далее по диаграмме | ||
| Состав в: | ||
| T > Tв | Lв | |
| Т = Тв | Lв + кр.В | |
| Т1 < T < Тв | Lв > c + кр.В | |
| T = T1 | Lc + кр.В = AB | Начало химической реакции, в резуль- тате которой исчезает Lc |
| T < T1 | B + AB | |
| и далее по диаграмме |
Диаграмма состояния двухкомпонентной системы с явлением ликвидации
Ликвация – расслоение жидкости на две, каждая из которых имеет свой состав и свои свойства.
Внешний вид диаграммы показан на рис.21. Область концентраций, для которых наблюдается явление ликвации, ограничена кривой F-L1-L2-G. Пути кристаллизации составов данной диаграммы приведены в табл.7.
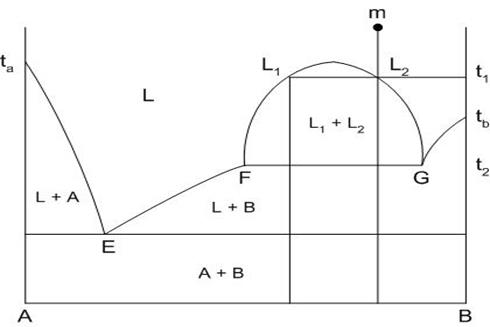 |
Рис.21. Диаграмма состояния двухкомпонентной системы с явлением ликвации
Таблица 7 – фазовые изменения в системах с ликвацией
| Температура | Равновесные фазы | Примечание |
| Состав m: | ||
| T = T1 | L1 + L2 | Расслоение жидкой фазы на две |
| T2 < T < T1 | L1→f + L2→g | |
| T = T2 | Lf + Lg + B | Кристаллизация В идет из расплава Lg |
| Te < T < T2 | Lf→e + B | |
| T = Te | Le + B + A | |
| T < Te | B + A |
Кристаллизация компонента В при температуре Т2 идет из расплава, который содержит в себе большее количество этого компонента, то есть из расплава G, состав которого меняется по прямой GF к точке F. В точке F составы расплавов сравниваются и ликвация как явление пропадает.
Диаграммы состояния двухкомпонентных систем с твердыми растворами
Если содержащиеся в твердом растворе компоненты могут смешиваться в любых соотношениях, то мы имеем дело с твердыми растворами неограниченной растворимости или непрерывным рядом твердых растворов (рис.22 левый рисунок).
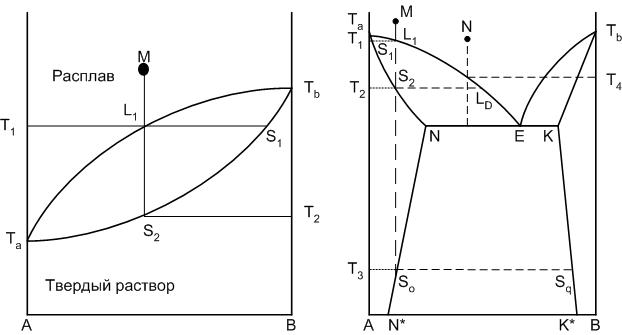
Рис.22. Диаграммы равновесия двухкомпонентных систем с твердыми растворами
При наличии однофазного твердого раствора из двух компонентов, находящегося в равновесии с расплавом, состоящим их тех же компонентов, степень свободы системы будет равна единице, то есть каждой температуре соответствует строгая концентрация компонентов в твердом растворе и расплаве. На диаграмме появляется кривая, показывающая изменение состава твердой фазы при изменении температуры (кривая Та-S1-Тв). Составы равновесных расплава и твердого раствора определяются концами конноды, проведенной при заданной температуре, например между точками L1 и S1. Когда точка М достигнет линии ликвидуса, начинается кристаллизация твердого раствора S1. При дальнейшем понижении температуры состав жидкости меняется по кривой ликвидуса, состав твердого раствора – по кривой солидуса. При температуре Т2, когда состав твердого раствора совпадает с исходным составом системы, кристаллизация закончится. Изменение состава твердого раствора в процессе кристаллизации происходит за счет диффузии атомов или ионов одного компонента в кристаллической решетке.
Если смешиваемость компонентов происходит лишь до некоторых пределов концентраций, то такой твердый раствор называется твердым раствором с ограниченной растворимостью. При эвтектической температуре в равновесии с расплавом находятся два твердых раствора: α и β. Точки N и К – точки предельной концентрации твердых растворов, которая изменяется при понижении температуры по линиям предельной растворимости (например, для твердого раствора α линия предельной растворимости компонентов А и В – N-N*).
На диаграмме составов, пути кристаллизации которых отличаются друг от друга, можно выделить три интервала: А-N*, N*-N, N-E, если рассматривать точку эвтектики как точку симметрии диаграммы. Пути кристаллизации составов, находящихся в интервале A-N*, не отличаются от путей кристаллизации составов с твердыми растворами неограниченной растворимости (рис.22 а). Пути кристаллизации других составов системы приведены в табл.8.
Таблица 8 – фазовые изменения в системах с твердыми растворами
| Температура | Равновесные фазы | Примечание |
| Состав m: | ||
| Т = Т1 | L1 + тв.р-р | Состав твердого раствора – S1 |
| Т→Т2 | L(1→D) + S(1→2) | |
| Т = Т2 | тв.р-р (S2) | Кристаллизация закончилась |
| Т = Т3 | тв.р-р (So)+ тв.р-р (Sq) | Разделение в твердой фазе на два раствора |
| Т < Т3 | тв.р-р (So- > n*) тв.р-р (Sq- > k*) | Изменение концентрации твердых растворов по линиям предельной растворимости |
| Состав n: | ||
| Т = Т4 | тв.р-р (S4) + расплав L4 | (составы условно не показаны) |
| Т = Те | тв.р-р (Sn)+ тв.р-р (Sk)+ | Кристаллизация закончилась |
| Т < Те | тв.р-р (Sn- > n*) тв.р-р (Sk- > k*) | Изменение составов твердых растворов |
Практическое значение диаграмм состояния уравнения двухкомпонентных систем
Для производства строительных материалов большое значение имеют составы исходных смесей, подобранные на основе диаграмм двухкомпонентных систем СаО – SiO2, CaO – Al2O3, Al2O3 + SiO2 и ряда других. Рассмотрим подробнее указанные системы.
Система CaO – SiO2
Система имеет важное техническое значение при производстве портландцементного клинкера и цементов на его основе. Диаграмма системы показана на рис.23.
В данной системе существуют четыре химического соединения: C3S, C2S, C3S2, CS.
Метасиликат кальция CaO*SiO2 (CS). Структура минерала относится к цепочечным силикатам Ca[SiO3]. Минерал имеет две полиморфные модификации: α-CS и β-CS.
Высокотемпературная модификация: псевдоволлостанит α-CS встречается в продуктах кристаллизации стекол и шлаков. Природный воллостанит β-CS кристаллизуется из стекол при температуре 1000оС в виде длинных иголок.
Трехкальциевый дисиликат 3CaO*2SiO2: Ca3[Si2O7]. Минерал плавится инконгруентно при температуре 1364оС, разлагаясь на белит и расплав состава 44,5% кремнезема и 55,5% CaO. В природе встречается в виде редкого минерала ранкинита: обнаружен в некоторых технических продуктах, например в доменных шлаках.
Двухкальциевый силикат 2CaO*SiO: Ca2[SiO3]. Минерал относится к ортосиликатам кальция. Главная структурная особенность ортосиликата кальция – склонность к образованию полиморфных модификаций (рис.24).
 Три из четырех полиморфных модификаций имеют область стабильного существования. Метастабильная форма отросиликата кальция – β модификация не имеет при нормальном давлении температурной области устойчивого существования, но может существовать при определенных условиях при температуре ниже 675оС.
Три из четырех полиморфных модификаций имеют область стабильного существования. Метастабильная форма отросиликата кальция – β модификация не имеет при нормальном давлении температурной области устойчивого существования, но может существовать при определенных условиях при температуре ниже 675оС.
Все превращения, за исключением β → γ, носят энантиотропный характер. При охлаждении расплава сначала кристаллизуется α-C2S, переходящая при понижении температуры в α’-C2S. Теоретически при дальнейшем охлаждении должен кристаллизоваться γ-C2S, однако на практике реализуется правило Оствальда: последовательность полиморфных модификаций α → β → γ. Это объясняется меньшими структурными изменениями системы при переходе α → β.
 |
Рис.24. Схема полиморфных превращений двухкальциевого силиката
Для всех модификаций ортосиликата кальция характерно то, что они построены из независимых кремнекислородных тетраэдров, связанных между собой катионами кальция с координационным числом 6 … 9.
Плотность α-C2S составляет 3,28 г/см3, плотность β-C2S – 2,97 г/см3; указанный выше переход сопровождается расширением системы на 12% и самопроизвольным переходом минерала в тонкодисперсное состояние. Этот процесс носит название «силикатный распад».
Модификация, в которой ортосиликат кальция присутствует в технических продуктах, оказывает решающее значение на их свойства. Только нестабильный β-C2S обладает гидравлической активностью и является основным минералом портландцементного клинкера. Поэтому на практике при производстве цемента необходимо получить ортосиликат кальция в виде его метастабильной модификации, предотвратив переход β-C2S в γ-C2S.
Указанная стабилизация может осуществляться различными способами. Одним из них является кристаллохимическая стабилизация, основанная на образовании ортосиликатом кальция твердых растворов с оксидами бария, хрома, фосфора, которые вводятся в состав шихты в количестве до 1%.
Другая форма стабилизации – понижение температуры термической обработки сырья до 1050 … 1100оС, а также быстрое охлаждение клинкера, когда не происходит перегруппировка атомов кристаллической решетки. Кроме того, быстрое охлаждение сохраняет в продуктах обжига стекловидную фазу, обволакивающую зерна ортосиликата кальция и механически препятствующую их расширению.
γ-C2S, стабильный при нормальных температурах, не обладает гидравлической активностью: небольшое количество ионов-сульфатов и ионов хлора усиливают его вяжущие свойства.
Трехкальциевый силикат 3CaO*SiO2: Ca3[SiO5]. Основной минерал портландцементного клинкера, представленный в нем в виде твердого раствора C3S с оксидами алюминия и магния. Чистый C3S разлагается ниже температуры 1250оС на отросиликат кальция и СаО. Распад трехкальциевого силиката предотвращается резким охлаждением, поэтому при комнатной температуре минерал находится в метастабильном состоянии, что усиливает его вяжущие свойства.
5.8.2. Система Al2O3 – SiO2
На рис.25 приведена диаграмма состояния диаграмма состояния системы Al2O3 – SiO2 по Н.А.Торопову и Ф.Я.Галахову. Согласно этой диаграмме химическое соединение 3Al2O3*2SiO2 – муллит плавится конгруентно при температуре 1910оС и имеет две эвтектики: одну с кремнеземом при температуре 1585оС, другую с твердым раствором глинозема в муллите и глиноземом при 1850оС. Область твердых растворов муллита с глиноземом находится в пределах 71,8 … 78% Al2O3.
Особенностью диаграммы является пологий характер кривой ликвидуса Е1-С, что свидетельствует о быстром нарастании количества жидкой фазы при нагревании и быстрой кристаллизации при охлаждении.
Муллит редко встречается в природе, в основном как продукт действия огненно-жидких лав на глинистые породы. Чаще муллит встречается в составе технических силикатов: алюмосиликатных огнеупоров, фарфора, строительной керамики и т.п. как конечный продукт обжига глин и каолинов:
3(Al2O3*2SiO2*2H2O) → 3Al2O3*2SiO2 + 4SiO2 + 6H2O.
Муллит обладает высокой химической стойкостью и огнеупорностью.
На основе диаграммы приготавливаются составы шихты для производства шамотных, муллитовых, корундовых и динасовых огнеупоров, муллитовой и корундовой технической керамики.
Шихта с содержанием 0,2 … 1,0% оксида алюминия является сырьем для производства динасовых (кремнеземистых) огнеупоров. Их огнеупорность составляет 1730оС, механическая прочность 15 … 35 МПа. Изделия обладают малой термической стойкостью и используются для кладки сводов и стен мартеновских и стекловаренных печей.
При 40 … 60% глинозема в составе шихты она используется для производства шамотных огнеупоров, характеризующихся высокой термической стойкостью.
Высокоглиноземистые огнеупоры (температура огнеупорности до 2000оС) содержат в составе шихты от 60 до 90% оксида алюминия. Плавленый корунд (Al2O3 до 99%) получают путем высокотемпературного обжига технического глинозема. Корундовые огнеупоры обладают высокой химической стойкостью, стойкостью против абразивного воздействия и эрозии.

Рис.25. Диаграмма Al2O3 – SiO2
5.8.3. Система CaO – Al2O3
Диаграмма, представленная на рис.26, не отностится к силикатным системам, но используется в производстве портландцемента, глиноземистого и высокоглиноземистого цементов, технической керамики.
В системе существуют пять химических соединений: С3А, С5А3, СА, СА2, СА6.
Трехкальциевый алюминат 3CaO – Al2O3 – один из минералов портландцементного клинкера, имеет высокую гидравлическую активность, обеспечивает быстрое твердение цемента, ответственен за долговечность изделий на основе портландцемента.
Минерал 5CaO –3 Al2O3 содержится в составе глиноземистого цемента, обладая малой гидравлической активностью. Состав минерала иногда в технической литературе изображают формулой С12А7.
Моноалюминат кальция CaO – Al2O3 – основной минерал глиноземистого цемента. Образует твердые растворы с оксидами железа и других металлов. Обладает высокой скоростью взаимодействия с водой.
Минерал CaO – 2Al2O3 содержится в небольших количествах в глиноземистом и является основным минералом высокоглиноземистого цемента.
CaO – 6Al2O3 – малоизученное соединение, найденное в плавленом корунде.
 |
Рис.26. Диаграмма CaO – Al2O3
Дата добавления: 2019-02-07; просмотров: 956;
