Диаграммы состояния однокомпонентных систем 1 страница
Для неконденсированной однокомпонентной системы согласно правилу фаз максимальная степень свободы равна двум:
fmax=K (1) +2-Pmin (1)=2
основными параметрами такой системы являются температура и давление. Общий вид диаграммы ²температура-давление² однокомпонентной системы указывает области существования каждой из фаз в зависимости температуры и давления.
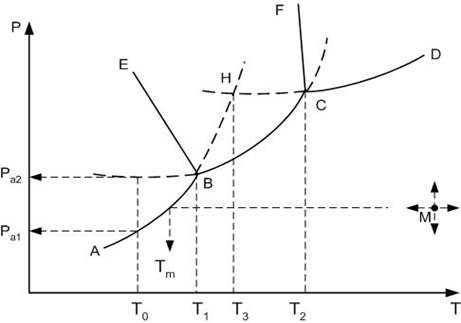 |
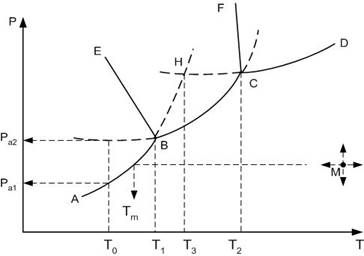
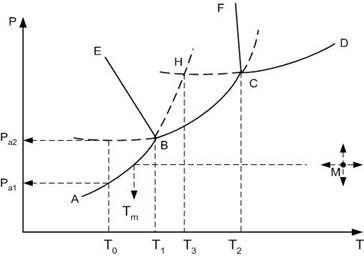
На рис рассмотрен случай, когда компонент А имеет две полиморфные модификации: низко- А1 и высокотемпературной А2.
Все области диаграммы являются однофазными: ниже кривой АВСD в системе в равновесии находится пар; выше кривых FCD – жидкость, EBSF – высокотемпературная модификация А2, АВЕ – низкотемпературная модификация А1. В границах этих областей можно произвольно менять два параметра: температуру и давлении, без изменения числа и природы фаз.
 |
Например, для состояния системы, обозначенного на рис. точкой М, можно в некотором интервале менять температуру (при постоянном давлении минимальной температурой при этом будет температура Тм) или давление или одновременно оба указанных параметра. Степень свободы при этом изменяться не будет, так как не происходит изменения фазового равновесия: сохраняется парообразное состояние вещества А.
Сплошные пограничные линии на диаграмме определяют дивариантное состояние системы: вдоль этих линий в равновесии находятся две фазы.
Так, вдоль кривой АВ в равновесии находятся кристаллы низкотемпературной модификации А1 и пар, ВС – кр.А2 + пар, СД – расплав компонента А + пар, ВЕ – кр.А1 + кр.А2, СF – кр.А2 + расплав.
 |
. Диаграмма однокомпонентной системы с энантиотропными полиморфными модификациями компонента
Если фазовое равновесие системы описывается точкой, принадлежащей какой либо пограничной линии, то в этом случае произвольно можно изменять только один из параметров: или температуру, или давление. При этом второй параметр будет принимать строго определенное пограничной линией значение. В этом смысле можно говорить о том, что пограничные линии представляют собой графическое изображение функциональных зависимостей давления от температуры (или наоборот) протекания каких-либо фазовых превращений.
Например, пограничная линия ВЕ представляет собой функциональную зависимость давления полиморфного превращения А1 в А2 от температуры (в примере давление возрастает с понижением температуры полиморфного превращения).
В системе существует две точки, когда степень свободы равна нулю, т.е. нонвариантное состояние системы. При этом в равновесии находятся одновременно три фазы: точка В (в равновесии кр.А1 + кр.А2 + пар) и точка С (кр.А2 + расплав + пар).
В этих точках невозможно изменять значения термодинамических параметров без изменения числа фаз.
Например: нонвариантное состояние для воды будет определяться значениями температуры +0,01оС и давления 6,03*10-3 атм., когда в равновесии будут находиться жидкая вода, лед и водяной пар.
Выше было отмечено, что сплошными линиями на диаграмме указывались стабильные состояния системы. Однако при определенных условиях (как правило, высокие скорости изменения температуры системы) можно получать фазы, существующие некоторый промежуток времени в области стабильного существования другой равновесной фазы.
Например, быстрым охлаждением воды можно фиксировать ситуацию, когда при нормальном давлении вода в жидком состоянии будет существовать при температурах до минус 8оС, когда равновесной фазой должен быть лед.
Эта ситуация носит название не(мета)стабильного состояния. Термодинамически метастабильное состояние неустойчиво, и такие системы самопроизвольно стремятся перейти в свое стабильное состояние. Однако скорость перехода будет определяться различными факторами и может быть практически незначимой. Из строительных материалов стекла, в том числе силикатные, являются метастабильными системами, существующими длительный промежуток времени в этом состоянии из-за высоких значений их вязкости.
На диаграммах метастабильные состояния указываются пунктирными линиями.
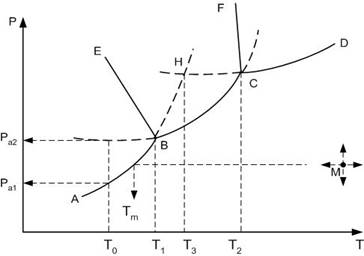 |
Например, продолжение пограничной линии АВ в область EBCF стабильного существования высокотемпературной модификации А2 (пунктирная линия ВН), определяет метастабильное фазовое равновесии кр.А1 + пар в области стабильного существования кр.А2. При этом точка Н, образованная пересечением продолжения линий упругости пара низкотемпературной модификации АВ и упругости пара расплава СД, будет определять температуру плавления низкотемпературной модификации А1.
Следует отметить, что для неустойчивого метастабильного состояния при фиксированной температуре упругость пара над поверхностью неустойчивой фазы будет всегда больше, чем над поверхностью устойчивой в данных условиях фазы.
Например: при температуре То давление пара над метастабильной высокотемпературной модификацией А2 будет больше, чем для стабильной А1, т.е. РА2 больше РА1.
Угол наклона линий зависимости равновесного давления от температуры для различных процессов (например, линия ВЕ) можно определить, используя уравнение Менделеева-Клайперона
P/T = Q / (T*(V2 – V1)),
где Q – теплота фазового превращения,
V1 и V2 – удельные объемы низко- и высокотемпературных модификаций.
Например, угол наклона кривой зависимости давления фазового перехода воды в лед от температуры будет тупой, так как удельный объем льда будет больше удельного объема воды.
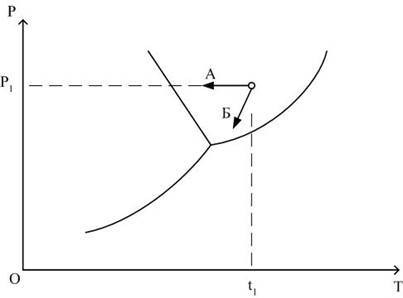
Таким образом, угол наклона будет тупым, если высокотемпературная модификация будет иметь большую плотность: повышение давления при этом снижает температуру фазового перехода.
Существуют и иные графические изображение диаграмм однокомпонентных систем
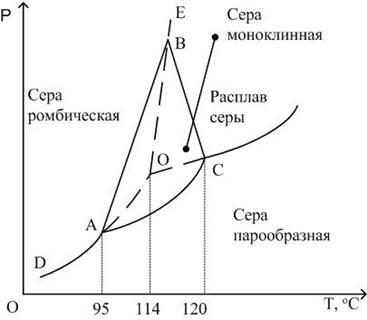
Для силикатных систем характерным является снижение плотности при повышении температуры и угол наклона кривой будет острым (чуть ниже 90 градусов).
Типы полиморфных превращений
Существует два типа полиморфны превращений: энантиотропные (обратимые) и монотропные (необратимые).
Диаграмма энантиотропных превращений представлена на рис.14, а схема превращений подобного типа приведена ниже.

Отличительными признаками энантиотропных превращений являются:
1. обе полиморфные модификации имеют области стабильного существования на диаграмме;
2. температуры плавления обеих полиморфных модификаций выше, чем температура перехода одной модификации в другую (на рис.14 температура Т3 больше Т1 и Т2).
Диаграмма монотропных превращений показана на рис.15.
Кривые АВ, cД и аF характеризуют соответственно давление насыщенных паров над жидкой фазой, неустойчивой модификации А2 и устойчивой модификации А1. Нонвариантная точка а соответствует фазовому равновесию газовой, жидкой и устойчивой А1 модификации, а точка с – равновесному состоянию газовой, жидкой и неустойчивой А2 модификации.
Рассмотрим охлаждение исходного состава системы М.
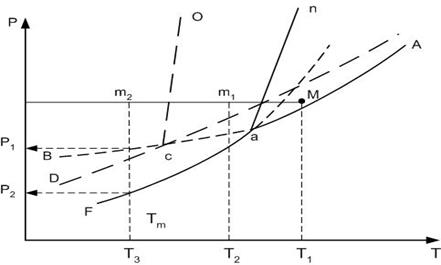 |
При снижении температуры при постоянном давлении точка М попадает на линию an, где начинается кристаллизация устойчивой формы А2. При небольших переохлаждениях расплава кристаллизация будет протекать более интенсивно.
Монотропные превращения полиморфных модификаций
Значительное переохлаждение, например до температуры Т3 при быстром снижении температуры, приводит к кристаллизации неустойчивой модификации А2, которая в дальнейшем перекристаллизовывается в устойчивую форму А1.
При монотропных превращениях переход одной модификации в другую необратим.

Невозможность перехода А1 в А2 обусловлена тем, что Р1 > Р2 а переход в направлении получения формы с большей упругостью пара противоречит первому и второму началам термодинамики.
Переход А1 в А2 возможен только путем расплавления неустойчивой модификации и последующим быстрым охлаждением расплава.
Рассмотренные превращения подчиняются правилу последовательных ступеней В.Оствальда: если вещество при данных условиях может образовывать несколько модификаций, то сначала кристаллизуется наименее устойчивая модификация, которая затем переходит в устойчивую через модификации промежуточной устойчивости.
Устойчивая модификация во всех случаях обладает меньшим давлением насыщенного пара, меньшей растворимостью (то есть меньшей химической активностью) и более высокой температурой плавления.
Примерами монотропных превращений могут являться переходы α в β модификации двухкальциевого силиката, превращение ромбического арагонита в тригональный кальцит.
Диаграмма состояния кремнезема
Диаграмма состояния кремнезема отличается сложным полиморфизмом (рис.16). Известны одиннадцать кристаллических полиморфных модификаций и две стеклообразные формы диоксида кремния.
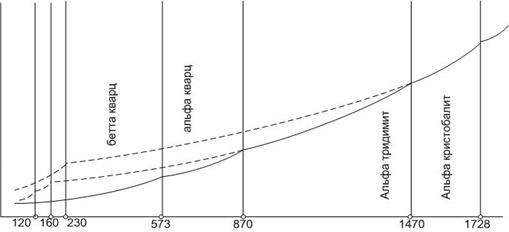
Рис.16. Диаграмма кремнезема с областями равновесных фаз
Кремнезем образует три главные кристаллические модификации: α-кварц, α-тридимит и α-кристобалит. Каждая из этих модификаций имеет, в свою очередь, несколько модификаций второго порядка, представленных на схеме полиморфных превращений кремнезема ниже:
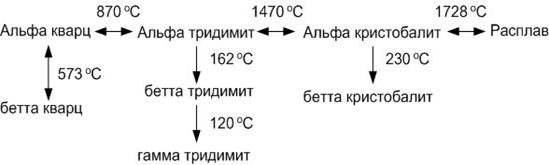
Все кристаллические модификации кремнезема можно разделить на две группы.
В первой группе представлены модификации, имеющие области стабильного существования на диаграмме (сплошные линии на рис.16). Это β- и α-кварц, α-тридимит, α-кристобалит. Пунктирными линиями на диаграмме показаны представители второй группы, не имеющие областей стабильного существования. Превращения внутри главной формы кремнезема (вертикальные ряды схемы полиморфных превращений) происходят быстро из-за незначительной перестройки кристаллической решетки. Превращения между главными формами кремнезема протекают медленно, в течение недель.
Указанные фазовые превращения ускоряются при введении в систему добавок минерализаторов: соединений щелочных и щелочноземельных металлов.
При изготовлении динасовых огнеупоров применяют в основном добавки минерализаторы оксидов кальция и железа.
Механизм действия добавок, вероятно, заключается в ускоряющем действии на процесс фазового перехода за счет появления в системе жидкой фазы, в которой растворяется неустойчивая и кристаллизуется устойчивая в данном температурном интервале полиморфная модификация кремнезема.
Все полиморфные модификации кремнезема сопровождаются изменениями плотности модификаций и, естественно, объемными превращениями.
При переходе от низко- к высокотемпературным формам кремнезема плотность снижается (табл.4). Объемные превращения при фазовых переходах могут достигать 15 и более процентов, что следует обязательно учитывать при проектировании технологических параметров (температура и скорости нагрева или охлаждения) процесса обжига изделий на основе сырья, содержащего кремнезем в свободном состоянии.
Таблица 4 – свойства полиморфных модификаций кремнезема
| Полиморфная модификация | Плотность, г/см3 | Полиморфные превращения | Изменение объема, % |
| α-кварц | 2,53 | α-кварц ↔ β-кварц | +4,5 |
| β-кварц | 2,65 | α-кварц ↔γ-кристобалит | +17,4 |
| α-тридимит | 2,22 | ||
| β-тридимит | 2,26 | ||
| γ-тридимит | 2,26 | ||
| α-кристобалит | 2,19 | ||
| β-кристобалит | 2,32 | ||
| расплав | 2,20 |
Диаграмма Феннера (рис.16) имеет больше теоретическое значение, так как на практике повсеместно наблюдаются отклонения от равновесного состояния из-за медленности превращений между главными формами кремнезема и высокой вязкости силикатного расплава.
Отклонения от равновесных состояний в системе кремнезема
1. Поскольку фазовые превращения между главными модификациями происходят очень медленно, при быстром нагревании могут перейти в расплав как α-кварц, так и α-тридимит, при этом температуры плавления этих модификаций ниже (соответственно 1610оС и 1710оС), чем у равновесной формы α-кристобалита – 1728оС.
С другой стороны, α-кристобалит при охлаждении превращается в нестабильный β-кристобалит, а α-тридимит в γ-тридимит, а не в равновесную форму кварца.
2. Расплав кремнезема легко переохлаждается, образуя кварцевое стекло, которое при температуре ниже 1000оС практически не кристаллизуется.
3. Из кварца при нагревании или кварцевого стекла при расстекловывании в качестве первичной фазы в широком интервале температур стремится выделиться кристобалит называемый метакристобалитом.
Дальнейшие возможные превращения протекают в соответствии с правилом Оствальда. Отклонения от равновесных состояний определяет тот факт, что в технических продуктах обжига (например, динасовом огнеупоре) основными кристаллическими фазами являются метастабильные в обычных условиях тридимит и кристобалит или кремнеземистое стекло.
5.1 Характеристика отдельных полиморфных модификаций кремнезема
Кварц (нем.Quarz) имеет две полиморфные модификации: α-кварц и β-кварц.

| 
| 
|

| 
| |
| Кварц с включениями рутила (Рутил – природный минерал, обладающий алмазным блеском и интересными оттенками, относится к классу оксидов и является рудой титана |
Природной формой является β-кварц, α-кварц в земной коре не встречается. Обе модификации относятся к каркасным силикатам. Структура α-кварца слагается из тетраэдров [SiO4], причем все анионы кислорода каждого тетраэдра являются обобществленными. Угол наклона между двумя соседними тетраэдрами (угол связи Si – O – Si) составляет 150о.
Схематические особенности структуры кварца показаны на рис. ниже.
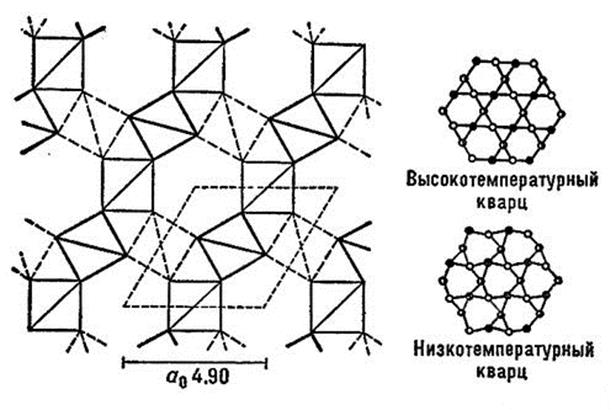
Рис.17. Структура кварца.
а – высокотемпературный α-кварц, б – низкотемпературный β-кварц
Группа тетраэдров в структуре кварца располагаются винтообразно вокруг некоторых осей, образуя спирали. В одной спирали тетраэдрами располагаются на разных уровнях: один тетраэдр (1) внизу, другой (2) – в середине и третий (3) – вверху. Эти тетраэдры дают один оборот спирали вокруг оси и затем последовательность слоев повторяется.
В одном кристалле кварца все спирали закручиваются в одну сторону, в другом – могут закручиваться в противоположном направлении. В зависимости от этого различают две формы кварца: левый (вращает плоскость поляризации света влево) и правый.
Структура α-кварца представляет собой несколько искаженную структуру β-кварца. При фазовом переходе происходит небольшое смещение катионов кремния, нарушая симметрию таким образом, что гексагональная ось превращается в тригональную. Сочленение между кремнекислородными тетраэдрами не нарушается.
С химической точки зрения кварц весьма устойчивое вещество. В воде практически нерастворим, из кислот его разрушают только плавиковая и фосфорная. Активнее кремнезем реагирует со щелочами, легко переходя в силикаты при сплавлении со щелочами или карбонатами щелочных металлов. Растворяют кварц также водные растворы едких и углекислых щелочей, особенно при нагревании.
Природный кварц является основным породообразующим минералом литосферы земли. Встречается в самых разнообразных формах: является составной частью многих горных пород, а также месторождений полезных ископаемых самого разнообразного генезиса. Наиболее важные для промышленности кварцевые материалы: кварцевые пески, кварциты (плотные, сцементированные или перекристаллизованные породы из зерен кварца) и кристаллический монокристальный кварц.
К скрытоскристаллическим разновидностям кварца относятся опал и халцедон, яшма и агат, кремень.
Цвет кристаллов, зерен и агрегатов кварца самый разнообразный. Чаще встречаются бесцветные, молочно-белые иди серые разновидности. Прозрачные или полупрозрачные красивоокрашенные кристаллы кварца получили особенные названия: бесцветные и прозрачные – горный хрусталь, фиолетовые – аметист, дымчатые – раухтопаз, черные – морион, золотисто-желтые – цитрин. Различные окраски обусловлены структурными дефектами при замене кремния в структуре тетраэдра на алюминий, железо с одновременным вхождением в кристаллическую решетку натрия, лития или гидроксил иона. В природе встречаются также сложноокрашенные кристаллы за счет микровключений посторонних минералов: золотистый мерцающий авантюрин – включения слюды или гематита.
Применение кварца разнообразно: изготовление строительного и художественного стекла, тонкой керамики (фаянс, фарфор), стеновой керамики, материалов автоклавного синтеза, растворов и бетонов на минеральных и органических вяжущих, огнеупоров различных видов.
Тридимит
Структура тридимита также слагается из кремнекислородных тетраэдров с углом связи в 180о. Характер связи в α-тридимите предопределяет крупную элементарную ячейку с менее плотной по сравнению с кварцем упаковкой: α и β модификации тридимита имеют структуру с несколько искаженной кристаллической решеткой главной модификации.
В технических и природных продуктах тридимит встречается в качестве продуктов расстекловывания технических стекол, а также образуется при перерождении кварца в динасовых огнеупорах при их длительной эксплуатации.
Кристобалит
Структура кристобалита слагается из кремнекислородных тетраэдров с углам силоксановой связи в 190о. Атомы кремния в структуре размещаются также, как атомы углерода в алмазе, то есть каждый атом находится в центре группы из четырех соседних атомов. Структура α-кристобалита построена из гексагональных плоских сеток тетраэдров. Сходную, но несколько искаженную структуру имеет β-кристобалит. β-кристобалит встречается в природных породах: опалах, бентонитах, может присутствовать в стеклах как продукт их расстекловывания, в динасе.
Сравнивая структуры модификаций первого порядка следует отметить, что их отличие состоит в разных схемах соединения тетраэдров друг с другом. Разница же между модификациями второго порядка не столь существенна: характер соединения не меняется, а несколько искажается симметрия структуры в результате смещения и вращения тетраэдров без разрыва каких-либо связей.
Модификации кремнезема, не присутствующие на диаграмме Феннера
На поверхности Земли или на незначительной глубине основной формой кремнезема, как мы уже отмечали, является кварц. Однако поиски иных форм кремнезема были связаны в первую очередь с тем, что температура и давление на глубине достигают высоких значений и это может приводить к качественным изменениям в структуре силикатов, основных породообразующих минералов. Экспериментируя с воздействием на кремнезем температурой и давлением были получены следующие модификации кремнезема: коэсит, китит, стишовит.
В исследованиях при высоких давлениях, предпринятых в США Л.Коэсом (Coes) в 1953 г, была получена при давлении около 3 ГПа новая фаза кремнезема, впоследствии названная коэситом. Плотность ее 3,01 г/см3. Это выше, чем у кварца, но анализ структуры показал, что кремний сохраняет в ней обычную координация по отношению к кислороду.
В 1961 г. молодые русские исследователи С.М.Стишов и С.В.Попова получили новую модификацию кремнезема (при давлениях 16 … 18*104 кг/см2 и температуре 1200 … 1400оС), названную стишовитом. Изучение физико-химических свойств стишовита показало, что его плотность, равная 4,35 г/см3 на 64% больше, чем у кварца, что объясняется изменением координации кремния с 4 на 6 по отношению к кислороду. Стишовит полностью устойчив к плавиковой кислоте, но хорошо растворяется в расплавах и растворах щелочей.
Кремнеземистое стекло
Кремнезем в виде стекла встречается в природе, а также легко получается искусственным путем. Обычное кремнеземистое стекло является наименее плотной формой кремнезема, обладая при этом рядом замечательных свойств:
- высокая химическая стойкость. Стойкость против действия всех кислот, за исключением плавиковой и ортофосфорной;
- низкий коэффициент термического расширения (КЛТР = 0,6*10-6 1/град);
- способность к пропусканию ультрафиолетовых лучей;
- высокая огнеупорность;
- высокая упругость.
При длительной эксплуатации при высоких температурах (1000оС) кремнеземистое стекло может расстекловываться (кристаллизовываться), выделяя в кристаллической фазе α-кристобалит. Расстекловывание само по себе не приводит к разрушению изделий, так как объемные деформации при этом невелики. Однако, если после длительной работы при высоких температурах изделие охладить ниже 150 … 275оС, оно может разрушиться под воздействием напряжений, возникающих при фазовом переходе α → β-кристобалит.
ТЕМА 3
Диаграммы состояния двухкомпонентных систем
При наличии в системе двух компонентов фазовые превращения усложняются: наряду с фазовыми превращениями, полиморфными модификациями компонента могут происходить и другие процессы, обусловленные взаимодействием компонентов.
Это определяет многообразие типов диаграмм систем с двумя компонентами. Рассмотрим сначала основные типы диаграмм, а затем некоторые диаграммы силикатных систем, практически применяемых в производстве вяжущих веществ, керамики, огнеупоров и некоторых других строительных материалов.
Тема 3 ДВУХКОМПОНЕНТНЫЕ СИСТЕМЫ
Диаграмма двухкомпонентной системы с одной точкой эвтектики
Для конденсированных систем, содержащих два компонента, максимальное число степеней свободы равно двум. При этом в качестве независимых термодинамических параметров принимают температуру и концентрацию первого компонента [С1]. Концентрация второго компонента [C2] рассчитывается по формуле: С2 = 100 – С1. Вертикальная ость диаграммы – ось температуры, горизонтальная ось – ось концентрации компонентов.
Внешний вид диаграммы приведен на рис.18. Левый конец горизонтальной оси концентраций компонентов, обозначенный буквой А, соответствует 100% содержанию компонента А, правый – 100% содержанию компонента В.
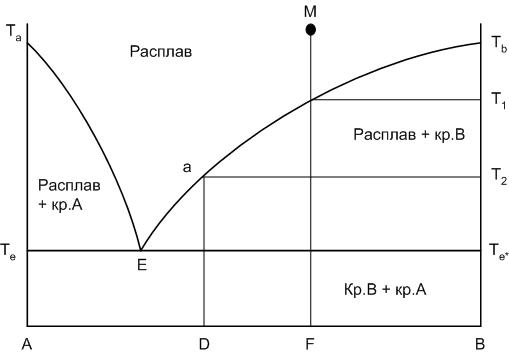
Рассмотрим основные элементы диаграммы.
Та и Тв – соответственно температуры плавления чистых компонентов А и В. Если точка состава находится на одной из вертикальных осей диаграммы (на А или В), то в этом случае мы рассматривает процессы, происходящие в однокомпонентной системе.
Кривые Та-Е и Е-Тв носят название кривых ликвидуса.
Кривые ликвидуса представляют собой температурные зависимости перенасыщения расплава по отношению к какому-либо компоненту или химическому соединению. Кривая Та-Е показывает температуру начала кристаллизации в системе компонента А из расплава при его охлаждении, кривая Е-Тв – соответственно начала кристаллизации компонента В.

Рис.18. Диаграмма двухкомпонентной системы
Точка Е носит название точки эвтектики и характеризует состав расплава с минимальной для данной системы температурой существования жидкой фазы: расплав эвтектического состава. Этот расплав пересыщен одновременно по отношению к обоим компонентам А и В. При кристаллизации расплава эвтектического состава компоненты выделяются в твердой фазе всегда в строго определенном соотношении, определяемом положением точки эвтектики.
Линия Те-Е-Те* носит название линии солидуса. Это линия окончания кристаллизации или начала плавления любого бинарного состава системы. Ниже линии солидуса в равновесии могут находиться только фазы в твердом состоянии. Следует также отметить, что линия солидуса не всегда горизонтальна.
Диаграмма равновесия позволяет определять последовательность фазовых превращений в системе при ее нагреве или охлаждении, фазовые равновесия при любых параметрах системы, рассчитывать количественное соотношение равновесных фаз при заданных условиях равновесия.
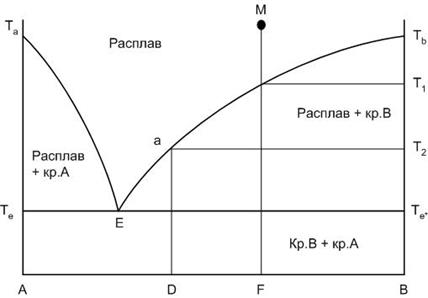
Рассмотрим последовательность фазовых превращений, происходящих при охлаждении исходного состава системы М (рис.18). Следует отметить, что если рассматривать нагрев исходного состава системы М, то последовательность фазовых превращений будет обратной его охлаждению, поэтому в дальнейшем мы будем рассматривать только кристаллизацию исходных составов.
Итак, начинаем охлаждать с постоянной скоростью расплав, соотношение компонентов в котором определяется точкой М.
Выше температуры Т1 в равновесии находится расплав Lm состава М. Число степеней свободы при этом равно двум: можно в некоторых пределах изменять температуру и состав системы (добавляя, например, в расплав кристаллы одного из компонентов, которые сразу же плавятся) без изменения фазового равновесия.
Указанное фазовое равновесие будет наблюдаться при охлаждении до температуры Т1. При температуре Т1, когда вертикаль исходного состава касается линии ликвидуса, расплав становится пересыщен по отношению к компоненту В, и начинается его кристаллизация. Так как степень свободы при этом становится равной единице, то при дальнейшем охлаждении при продолжающейся кристаллизации компонента В состав расплава будет меняться строго по линии ликвидуса.
Например, при температуре Т2 расплав будет иметь состав, определяемый положением точки а на линии ликвидуса Е-Тв.
Таким образом, на диаграмме в области, ограниченной точками Е-Тв-Те* в равновесии будут находиться две фазы: кристаллы компонента В и расплав, состав которого зависит от рассматриваемой температуры системы.
Дата добавления: 2019-02-07; просмотров: 1271;
