Химические свойства
2.3.1. Кислотные свойства
Фенол является кислотой более сильной, чем спирты и вода, но более слабой, чем угольная кислота. Для фенолят-аниона можно привести набор резонансных структур:
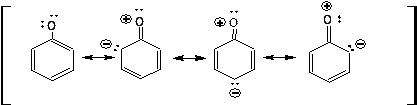
Наличие набора резонансных структур свидетельствует об устойчивости фенолят-аниона и достаточно высоких кис-лотных свойствах фенола. Соответственно фенол легко реаги-рует с раствором едкого натра с образованием фенолята:
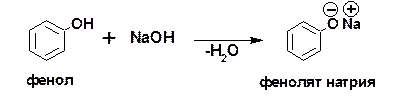
Электронодонорные заместители в пара- и орто-поло-жениях понижают кислотные свойства. Электроноакцепторные заместители в пара- и орто-положениях повышают кислотные свойства. Так 2,4,6-тринитрофенол обладает выраженными кис-лотными свойствами, поэтому называется пикриновой кисло-той. Он способен вытеснять угольную кислоту из ее солей, т.е. может образовывать фенолят в растворе соды.
Восстановление
Примером реакции, протекающей с разрывом связи С-О, является восстановление фенола цинковой пылью при пере-гонке. В ходе этой реакции гидроксильная группа замещается водородом:
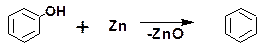
Связь между углеродом бензольного кольца и атомом кислорода гидроксильной группы обладает повышенной проч-ностью за счет частичной двоесвязанности. Поэтому реакции с разрывом связи С-О для фенола, в общем, не характерны.
2.3.3. О-Алкилирование фенола
Фенол является слабым основанием, поэтому в реакции алкилирования с галоидными алкилами обычно используют фенолят натрия:
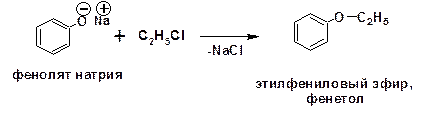
2.3.4. О-Ацилирование фенола
Кислотные свойства фенола играют позитивную роль в реакциях образования сложных эфиров карбоновых кислот. Так, хлорангидриды и ангидриды алифатических кислот взаимо-действуют с самим фенолом:
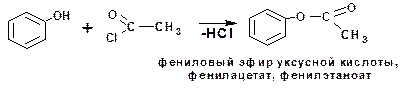
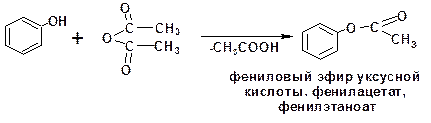
Хлорангидриды ароматических кислот, в частности бензойной, взаимодействуют с фенолом в присутствии едкого натра или в среде пиридина. Причиной этого является более прочная, по сравнению с алифитических системами, связь меж-ду атомами хлора и углерода. Соответственно хлорангидриды ароматических кислот ацилируются уже фенолятом:
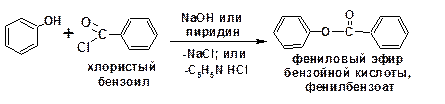
Так же образуются эфиры с хлорангидридами минеральных кислот.
2.3.5. Реакции замещения
Галогены реагируют с фенолом без катализатора. Фенол взаимодействует с бромом в водном растворе. Причем реакция не останавливается на стадии монобромирования. Сразу образуется 2,4,6-трибромфенол, который в дальнейшем превра-щается в тетрабромпроизводное:
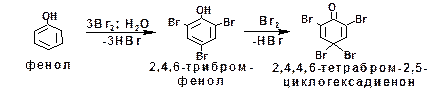
Аналогично под воздействием концентрированной азот-ной кислоты в присутствии серной кислоты фенол превращается в 2,4,6-тринитрофенол (пикриновую кислоту):
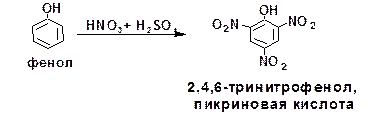
Мононитрофенолы образуются при нитровании фенола азотной кислотой в среде уксусной кислоты при комнатной температуре:
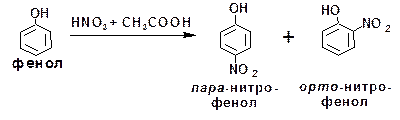
Два полученные изомера существенно различаются по своим свойствам. В отличие от пара-изомера, орто-нитрофенол не растворяется в воде, имеет более низкую температуру плавления и перегоняется с водяным паром. Эти особенные свойства орто-нитрофенола обусловлены наличием внутри-молекулярной водородной связи:
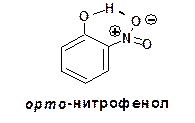
Ориентация электрофильного замещения в орто-положение характерна для фенола. Так, сульфирование фенола при температуре 15-200С приводит к образованию орто-фенол-сульфокислоты, а при температуре 1000С образуется пара-фенолсульфокислота:
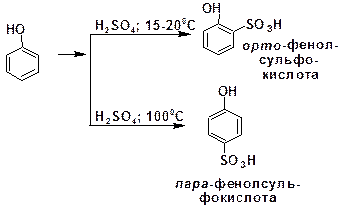
Сравнение условий показывает, что орто-фенолсуль-фокислота является продуктом кинетически контролируемым, а образование пара-фенолсульфокислоты контролируется термо-динамически.
2.3.6. Реакция Реймера-Тимана
При взаимодействии фенола со щелочным раствором хлороформа образуется салициловый альдегид:
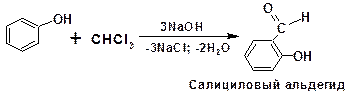
2.3.7. Реакция Кольбе-Шмитта
При взаимодействии сухого фенолята натрия с угле-кислым газом в две стадии получают салициловую кислоту:

2.3.8. Конденсация с формальдегидом
В присутствии кислот или щелочей фенолы легко конден-сируются с карбонильными соединениями: формальдегидом, уксусным альдегидом, бензальдегидом, фталевым ангидридом, ацетоном.
Конденсация с формальдегидом проходит по следу-ющему механизму:
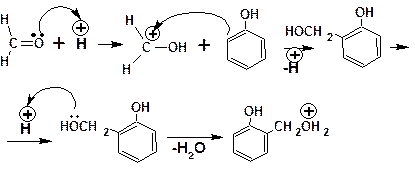
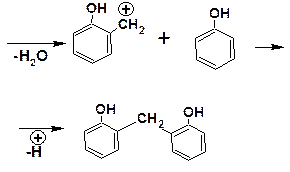
В соответствии с приведенным механизмом, предусматривающем замещение только в орто-положение, при низкой температуре образуется полимер (продукт поликон-денсации) линейного строения – новолачная смола:
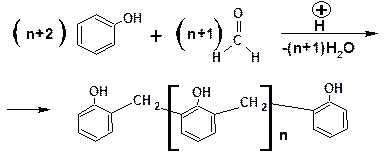
Определение. Процесс образования макромолекулы, сопровождающийся образованием низкомолекулярного побочного продукта, называется поликонденсацией.
При высокой температуре образуются продукты пара-замещения, что приводит к пространственной сшивке полимера. Таким путем получают твердые фенолформальдегидные смолы: – резиты:
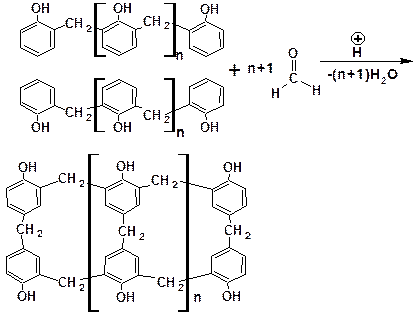
Окисление
При окислении фенола пероксидом водорода в присутствии железного катализатора образуется пирокатехин:
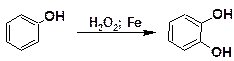
При воздействии хромовой кислоты на фенол и гидро-хинон образуется пара-бензохинон, из пирокатехина получается орто-бензохинон:
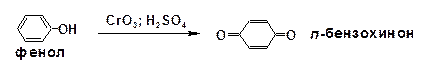
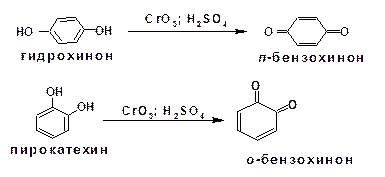
2.3.10. Восстановление
При гидрировании водородом в присутствии катали-затора фенолы превращаются в спирты, производные цикло-гексана:
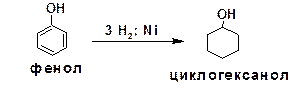
Восстановлением пара-бензохинона получают гидро-хинон:
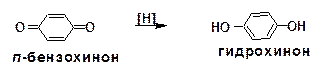
Альдегиды и кетоны
Общие положения
Определение. Производные углеводородов, содержащие карбонильную группу С=О, называются карбонильными соединениями.
Карбонильные соединения, в которых карбонильная груп-па соединена хотя бы с одним атомом водорода, называются альдегидами.
Карбонильные соединения, в которых карбонильная груп-па связана с двумя атомами углерода, называются кетонами.
Карбонильная группа построена из атомов углерода и кислорода, находящихся в состоянии sp2-гибридизации и соединенных друг с другом двойной связью. Наличие двойной связи предполагает склонность карбонильных соединений к реакциям присоединения. Причем наличие электроотрицательного атома кислорода в ненасыщенной системе делает двойную связь электрофильной, а, следовательно, для такой связи будут характерны реакции нуклеофильного присоединения.
Кроме того, повышенная электроотрицательность карбо-нильной группы по отношению к атомам углерода, находя-щимся в состоянии sp3-гибридизации, является причиной С-Н кислотных свойств карбонильных соединений, что, в свою очередь, обусловливает способность карбонильных соединений к реакциям с участием углеродного атома, находящегося в α-по-ложении по отношению к карбонильной группе.
Для карбонильных соединений действуют три номен-клатуры. По тривиальной номенклатуре альдегиды называют по названию соответствующей карбоновой кислоты. Кроме того, альдегиды могут иметь собственные, исторически сложившиеся названия.
Рациональная номенклатура характерна для альдегидов, имеющих больше двух углеродных атомов в скелете. Такие альдегиды рассматриваются как производные уксусного альдегида, в котором атомы водорода замещены на углеводородные радикалы. Кетоны в рациональной номенклатуре называют по радикалам, связанным с карбонильной группой.
По систематической номенклатуре название строится от исходного насыщенного углеводорода. Альдегидная группа по-лучает первый номер, а кетонная группа – наименьший. Альде-гидная группа в главной цепи обозначается суффиксом -аль, кетонная группа обозначается суффиксом -он.
Но если альдегидная или кетонная группа входят в состав бифункционального соединения, в котором есть группа, которая обозначается позже, то обозначение системы карбонильной группы вводится в префикс и обозначается следующим образом: альдегидная группа формил-, кетонная группа оксо-.
В случае перечисления нескольких функциональных групп альдегидная группа обозначается после кетонной, а они обе обозначаются после гидроксигруппы, кратной связи, алкильного радикала и галоида. Например:
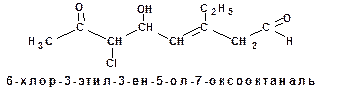
Названия кетонов, в которых карбонильная группа свя-зана с бензольным кольцом, включают суффикс -фенон.
Альдегиды:
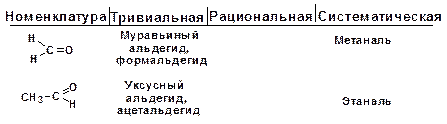
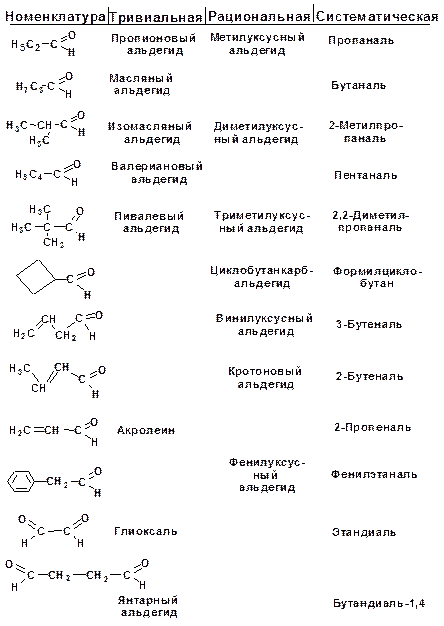
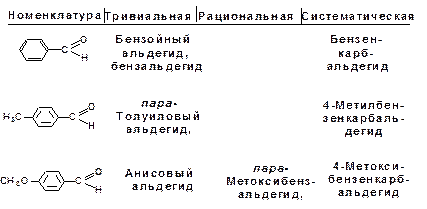
Кетоны:
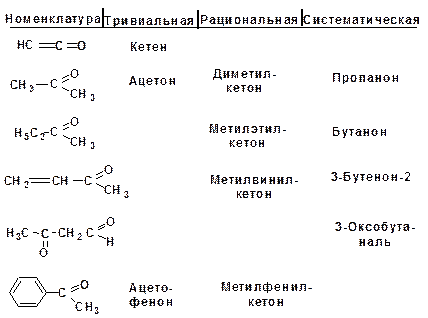
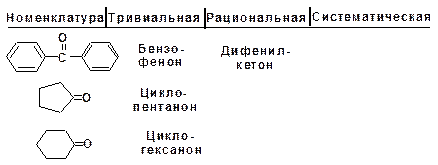
Способы получения
Дата добавления: 2018-09-24; просмотров: 2122;
