Химические свойства алканолов
СПИРТЫ. ФЕНОЛЫ. АЛЬДЕГИДЫ И КЕТОНЫ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Спирты
Общие положения
Определение. Гидроксипроизводные углеводородов, в молекулах которых гидроксигруппа присоединена к насыщен-ному атому углерода (атом углерода в состоянии sp3-гибридизации), называются спиртами.
По номенклатуре ИЮПАК насыщенные спирты называются алканолами. Количество гидроксильных групп определяет атомность спирта.
Для спиртов действуют тривиальная, рациональная и систематическая номенклатура. Рациональная номенклатура строится от метилового спирта или метанола, который в рацио-нальной номенклатуре называется карбинол. Остальные спирты рассматриваются как производные карбинола, к которому присо-единены различные радикалы. В систематической номенклатуре (ИЮПАК, IUPAC) наличие гидроксильной группы обозначается суффиксом -ол. Суффикс -ол добавляется к названию углеводорода: метан – метанол, этан – этанол и т.д. Гидроксигруппа обозначается после галоидов, углеводородных радикалов и кратных связей. Положение гидроксигруппы обозначается наименьшим значением локанта, если в составе молекулы отсут-ствует карбонильная и/или карбоксильная группа.
По строению углеводородной цепи различают спирты:
- насыщенные (когда углеводородный радикал построен из насыщенных атомов углерода);
- ненасыщенные (когда углеводородный радикал включает атомы углерода, соединенные кратной связью);
- ароматические (когда углеводородный радикал включает ароматическую систему):
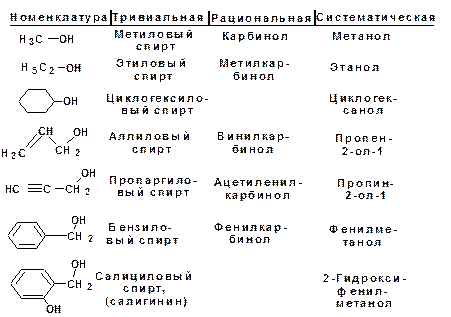
По типу атома углерода, с которым соединена гидроксигруппа, спирты классифицируют следующим образом:
- первичные, когда гидроксигруппа соединена с первичным атомом углерода (-СН2-ОН);
 - вторичные, когда гидроксигруппа связана с вторичным атомом углерода (-СН-ОН);
- вторичные, когда гидроксигруппа связана с вторичным атомом углерода (-СН-ОН);
- третичные, когда гидроксигруппа связана с третичным
 |
 атомом углерода (-С-ОН):
атомом углерода (-С-ОН):

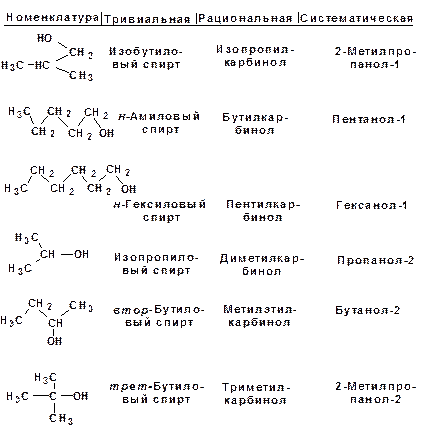
По числу гидроксильных групп в молекуле различают одно-, двух- и многоатомные спирты.

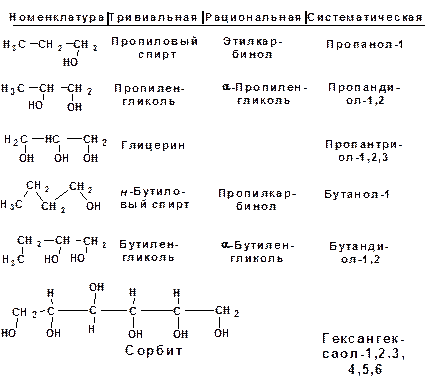
Для многоатомных спиртов, особенно двухатомных, характерна изомерия положения гидроксильной группы:
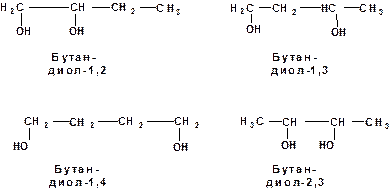
1.2. Способы получения алканолов
1.2.1.Гидратация алкенов в присутствии кислотного катализатора:
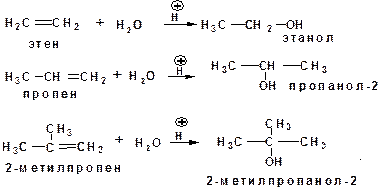
Гидратация этена, пропена и 2-метилпропена является промышленным способом получения этанола, пропанола-2 и 2-метилпропанола-2.
1.2.2. Гидроборирование алкенов:
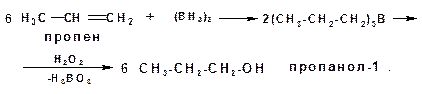
По данному методу алканол образуется в результате окисления продукта гидроборирования пероксидом водорода.
1.2.3. Гидролиз галогеналканов
Спирты получаются в результате действия раствора едкого натра в воде на галогенопроизводные алканов:
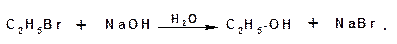
1.2.4. Синтез спиртов с использованием реактива Гриньяра
Присоединение реактива Гриньяра (магнийгалогенал-кила) к карбонильному соединению протекает в соответствии со схемой
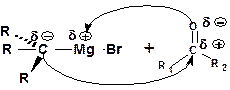
предусматривающей взаимодействие нуклеофильных центров с электрофильными (электростатическое взаимодействие отрица-тельных электрических зарядов с положительными).
Присоединение магнийгалогеналкила к формальдегиду (метаналь) приводит к образованию первичного спирта, со всеми остальными альдегидами образуются вторичные спирты. Присоединение реактива Гриньяра к кетонам приводит к образованию третичного спирта:
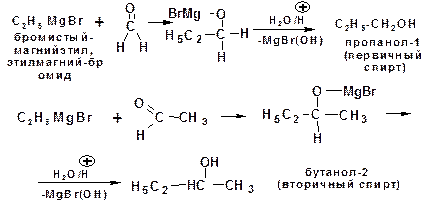
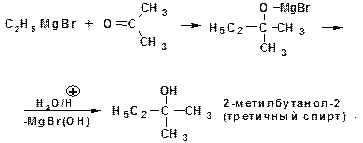
1.2.5. Синтез спиртов с использованием реактива Гриньяра и окисей алкенов:
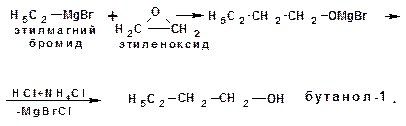
1.2.6. Восстановление оксида углерода (II) (окиси углерода):
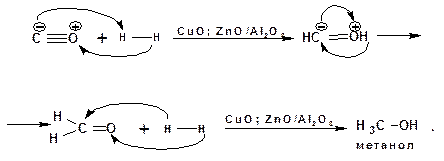
Восстановление оксида углерода (II) является промышленным способом производства метанола.
1.2.7. Восстановление карбонильных соединений:
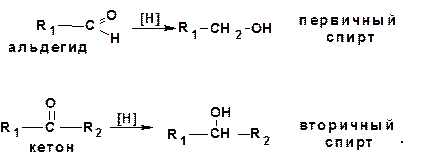
В качестве восстановителей используют боргидрид натрия (NaBH4) в спирте, литийалюминий гидрид (LiAlH4) в эфире, а также каталитическое восстановление водородом над никелевым, платиновым или палладиевым катализатором. При этом из альдегидов и сложных эфиров получаются первичные спирты, а из кетонов получаются вторичные спирты.
1.2.8. Восстановление сложных эфиров:
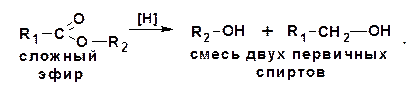
1.2.9. Спиртовое брожение:
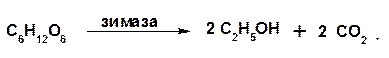
Наряду с гидратацией этена, спиртовое брожение также является промышленным способом производства этанола.
Химические свойства алканолов
1.3.1. Кислотные свойства
Кислотные свойства алканолов проявляются в способности взаимодействовать со щелочными и щелочно-земельными металлами (магний) с замещением атома водорода гидроксильной группы на катион металла:
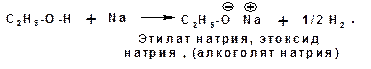
Алкоголяты легко гидролизуются:
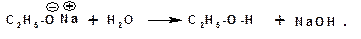
Кислотные свойства спиртов понижаются в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп, пони-жающих стабильность аниона.
1.3.2. Основные свойства
Основные свойства алканолов проявляются в способности спиртов взаимодействовать с кислотами Бренстеда:
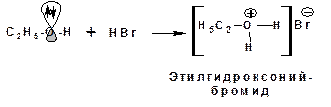
В молекуле спирта электронодонором является атом кислорода, обладающий неподеленной электронной парой (НЭП). По НЭП происходит присоединение протона кислоты Бренстеда.
Спирты являются слабыми основаниями. Основные свойства возрастают в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп.
1.3.3. Этерификация кислотами:
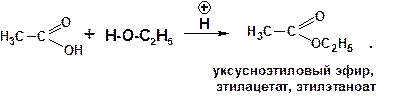
1.3.4. Реакции с галогеналканами
Спирты являются слабыми нуклеофилами и практически не реагируют с галогеналканами. Исключение составляют аллил и бензилгалогениды и некоторые третичные галогенпро-изводные. Поэтому в реакциях с галогеналканами используют алкоксид-анионы, которые являются сильными нуклеофилами и основаниями:
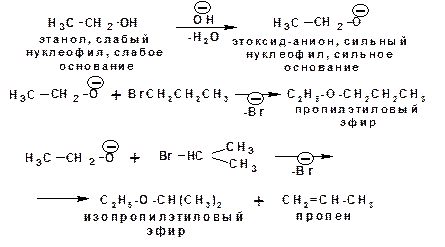
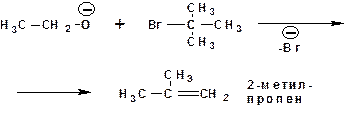
1.3.5. Этерификация минеральными кислотами:
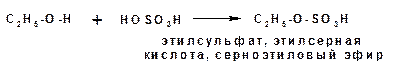
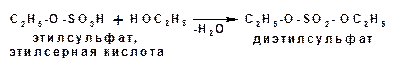
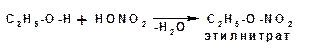
1.3.6. Дегидратация спиртов
Дегидратация спиртов протекает при действии водоотни-мающих средств. Такими веществами являются:
- кислоты: серная, фосфорная, щавелевая, бензолсуль-фокислота;
- оксиды алюминия и тория.
Существует два вида дегидратации: межмолекулярная и внутримолекулярная. При межмолекулярной дегидратации обра-зуются простые эфиры:
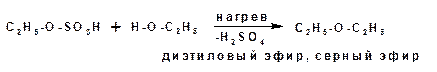
Механизм реакции включает две стадии. На первой стадии образуется сложный эфир серной кислоты, который на второй стадии вступает в реакцию нуклеофильного замещения со второй молекулой спирта:
В случае внутримолекулярной дегидратации спиртов, протекающей при более высокой температуре, от молекулы сложного эфира отщепляется молекула серной кислоты и обра-зуется молекула непредельного соединения. В этом случае на второй стадии протекает реакция элиминирования:
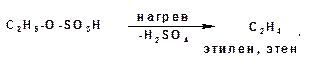
1.3.7. Реакции с галогеноводородами:
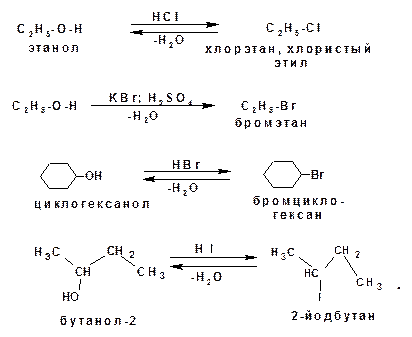
1.3.8. Реакции с галогенидами фосфора и серы:
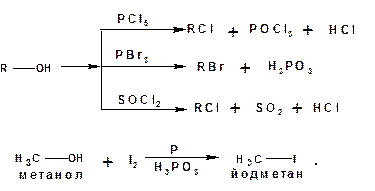
1.3.9. Окисление
В качестве окислителей спиртов могут быть использованы: хромовый ангидрид, хромовая кислота, перман-ганат калия, двуокись марганца и т.д. Во всех случаях первич-ные спирты дают альдегиды, а вторичные – кетоны. Кроме того, при пропускании паров первичного или вторичного спирта над медным катализатором при 3000С протекает реакция дегидро-генизации (дегидрирования) спиртов. В этом случае также из первичных спиртов получаются альдегиды, а из вторичных – кетоны:
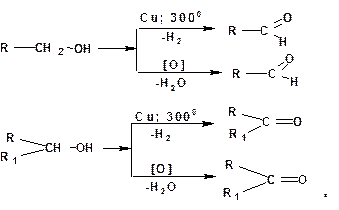
Дата добавления: 2018-09-24; просмотров: 3282;
