Механизм мышечного сокращения
В основе мышечного сокращения лежит взаимодействие между тонкими и толстыми протофибриллами ( актиномиозиновый комплекс), регулируемое ионами Са2+. Концентрация ионов Са2+ в саркоплазме клеток покоящейся (расслабленной) мышцы относительно низкая (< 10-7 М), за счет их постоянного перекачивания кальциевыми насосами из саркоплазмы в цистерны эндоплазматического ретикулюма. При действии электрического сигнала (нервного импульса), кальциевые каналы на мембранах эндоплазматического ретикулюма открываются, и транспорт ионов кальция по электрохимическому градиенту повышает их концентрацию саркоплазме. Связывание 4–х ионов Са2+ с ТпС приводит к запусканию цепи конформационных превращений белков тропонинового комплекса актиновой нити, связыванию ее с головкой миозиновой нити.
Тянущая сила, которая вызывает движение молекул миозина вдоль нитей актина, возникает за счет структурных изменений, происходящих в каталитическом центре миозина после гидролиза молекулы АТФ. Механизм работы миозина можно сравнить с функционированием механического устройства, в котором головка и шейка миозинового мостика выполняют роль своеобразного рычага, позволяющего существенно увеличить амплитуду смещения миозинового хвоста. Этот рычаг одним из своих концов опирается на актиновую нить, другой конец рычага соединен с хвостом молекулы миозина (рис. 3). При гидролизе АТФ в головке миозина происходят структурные перестройки, в результате которых зацепленная за нить актина головка миозина поворачивается на угол 30 - 40°, увлекая за собой хвост миозина . Так возникает сила, вызывающая скольжение толстых нитей миозина вдоль нитей актина.
Структурные перестройки, которые происходят в каталитическом центре фрагмента S1, характеризуются сравнительно небольшими смещениями атомов в активном центре. Однако эти изменения вызывают значительное перемещение хвоста миозина (3-5 нм для миозина скелетных мышц). Это происходит в результате того, что рычаг, передающий смещение от каталитического центра к хвосту миозина, имеет неравные плечи - точка опоры рычага находится существенно ближе к активному центру моторного фрагмента S1, чем конец шейки миозинового мостика, соединяющийся с хвостом миозиновой нити (см. рис. 4). Интересно, что у молекул миозина, принадлежащих различным классам, амплитуда смещения хвоста за один рабочий шаг может заметно отличаться. Это определяется тем, что длина рычага у разных форм миозина неодинакова (рис. 4, в). Так, например, у молекул миозина V, выполняющего функции транспортного белка, шейка в несколько раз длиннее, чем у миозина скелетных мышц (миозина II). Поворот головки миозина V на угол а - 30-40° приводит к смещению хвоста на расстояние 20 нм, что приблизительно в пять раз больше рабочего шага миозина скелетных мышц.
В процессе сокращения мышцы каждая головка миозина совершает многократные повороты, периодически изменяя угол своего наклона относительно нити актина. В расслабленной мышце миозиновый мостик отделен от актиновой нити (рис. 5, состояния 1 и 2). Свободная головка миозина обладает определенной степенью подвижности; за счет шарниров, расположенных в местах соединения фрагментов S1 и S2, угол ее наклона относительно хвоста может изменяться. При связывании молекулы АТФ с активным центром миозина его головка остается отсоединенной от актина ( состояние 7). В каталитическом центре миозина молекула АТР расщепляется на ADP и Р, (рис. 5, переход "состояние 1- состояние 2"). Образующиеся при этом молекулы ADP и Р, остаются прочно связанными с каталитическим центром. Гидролиз молекулы АТР сопровождается присоединением головки миозина к актиновой нити: сначала образуется слабая связь (состояние 3), затем возникает более прочная связь (состояние 4). При этом вращательная подвижность миозинового мостика становится ограниченной. Прочное связывание головки миозина с актином инициирует освобождение фосфата Р, из активного центра (переход "состояние 4- состояние 5"). Изменения, происходящие в каталитическом центре после отщепленияР, вызывают дополнительное увеличение сродства миозина к актину. В результате этого появляется сила, вызывающая поворот мостика в сторону хвоста (переход "состояние 5- состояние 6"). Вместе с поворотом мостика смещается вдоль нити актина хвост миозина, который соединен с мостиком с помощью "шарнирного" сочленения. Благодаря продольному смещению хвоста миозина происходит сокращение длины саркомера. После смещения головки миозина, молекула ADP освобождается из каталитического центра, а ее место занимает новая молекула АТР (переход "состояние 7 -состояние 8"). Это превращение сопровождается отсоединением головки миозина от актина, завершающим цикл структурных преобразований, происходящих в активном центре миозина. В результате многократно повторяющихся циклов гидролиза АТР возникает направленное скольжение нитей миозина и актина друг относительно друга.
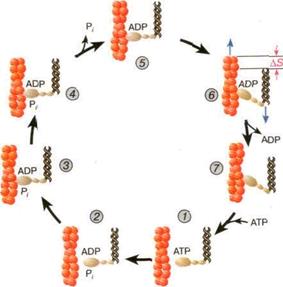
Рис. 5. Цикл структурных превращений актино-миозинового комплекса, приводящих к смещению молекулы миозина вдоль нити актина
В мышечных волокнах молекулы миозина работают не индивидуально, а кооперативно, в составе крупных макромолекулярных ансамблей. Как мы уже отмечали, в миофибриллах молекулы миозина собраны в жгуты, из которых выступает множество миозиновых мостиков в сторону нитей актина (см. рис. 4). Показано, что во время сокращения мышцы лишь сравнительно небольшая часть мостиков (10—15%) одновременно находится в контакте с окружающими их нитями актина. Это значит, что каждый из мостиков большую часть времени проводит в свободном состоянии, когда он непосредственно не создает тянущей силы. При этом молекулы миозина, у которых мостики отсоединены от актиновых нитей, во время сокращения саркомера перемещаются вместе с остальными молекулами миозинового жгута. Такое движение свободных (несвязанных) мостиков происходит за счет работы других мостиков, которые в это время непосредственно взаимодействуют с нитями актина. Это значит, что каждый мостик не просто шагает вдоль нити, равномерно ступая между соседними звеньями актиновой цепи, а как бы прыгает вдоль нее. Длина таких прыжков составляет 36—38 нм (рис. 6, а), что многократно превышает размер индивидуального шага (As = 4 нм). Таким образом, сокращение мышечных волокон обеспечивается за счет кооперативной работы большого количества молекул миозина, собранных в толстые нити. Движение пучка молекул миозина вдоль нити актина можно сравнить с перетаскиванием бревна большой группой работников, из которых лишь небольшая часть тружеников (10—15%) опирается ногами на землю, в то время как остальные работники в это время висят на бревне, не касаясь земли. Подобно мостикам миозина, работники периодически меняются ролями, однако в каждый момент времени активно работает лишь небольшая часть тружеников, несущих бревно вместе с висящими на нем товарищами (рис. 5,6).
Кооперативный способ работы молекул миозина, характерный для скелетных мышц, встречается также в некоторых других сократительных системах. Известна, однако, большая группа моторных белков, которые работают индивидуально; цикл их механохимических превращений протекает в равномерном режиме, а перемещение происходит отдельными шагами, без длинных прыжков, характерных для миозина скелетных мышц. К таким молекулярным моторам относятся некоторые классы внемышечных миозинов, работающих в клетках животных и растений в качестве перевозчиков мембранных частиц. Простейшие молекулы миозина, выполняющие работу индивидуальных переносчиков (например, миозин класса I), имеют глобулярную головку и короткий хвост.
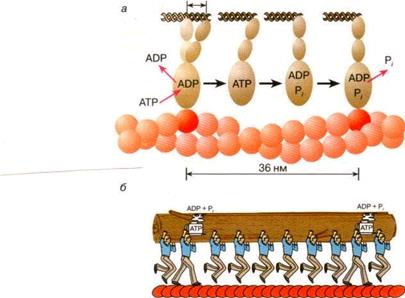
Рис. 6.Схема перемещения молекулы миозина вдоль нити актина
Двигаясь вдоль нити актина цитоскелета, молекула-переносчик может тащить за собой органоид, к которой она прикрепляется своим хвостом. Таким способом молекулы миозина осуществляют перенос различных частиц и органоидов в клетке.
Движение органоидов при помощи белков-переносчиков хорошо исследовано в гигантских клетках зеленой водоросли Nitella. На периферии клетки, рядом с плазматической мембраной, находится слой хлоропластов. Хлоропласты примыкают к так называемому кортикальному слою, который содержит пучки актиновых нитей цитоскелета. Между неподвижными кортикальным слоем и мембраной вакуоли расположен слой движущейся цитоплазмы, в котором находятся ядра, митохондрии и другие органеллы. Молекулы миозина совершают круговое движение внутри клетки, равномерно перемещаясь вдоль нитей актина и увлекая за собой сравнительно крупные органеллы (митохондрии, эндоплазматический ретикулум, ядра и др.). Скорость перемещения органелл составляет 50-75 мкм/с. Благодаря такому движению, в гигантской клетке водоросли возникает циркуляция цитоплазмы, за счет которой ее содержимое перемешивается гораздо быстрее, чем это происходило бы путем простой диффузии. Гигантские клетки зеленых водорослей достигают длины 2-5 см, поэтому без принудительной циркуляции цитоплазмы молекулам белков потребовалось бы около 10 суток для диффузии с одного конца клетки на другой.
Пока не разгадан механизм движения хлоропластов в цитоплазме клеток водорослей и высших растений. Известно, что при освещении растений хлоропласты быстро перемещаются внутри клетки, собираясь вблизи клеточной стенки. Хлоропласты зеленой водоросли Chara могут часами вращаться (один оборот за 2-3 с) в одном и том же направлении в капле протоплазмы, выдавленной из клетки.
В работах В.П. Скулачева с сотрудниками показано, что вращение хлоропластов - это энергозависимый процесс, который поддерживается за счет протонного потенциала. Однако, механизмы использования энергии мембранного потенциала для движения хлоропластов пока неизвестны.
Хорошо изученным из внутриклеточных двигательных белков являются молекулы кинезинового типа. Кинезин в животных клетках выполняет функцию переносчика различных органоидов (митохондрий, лизосом) и внутриклеточных частиц. В клетках дрожжей найдено шесть белков, похожих на кинезин. В клетках мышей обнаружено более двух десятков подобных белков. Двигаясь вдоль микротрубочек (рис. 7), молекула кинезина может тянуть за собой сравнительно крупные субклеточные частицы.
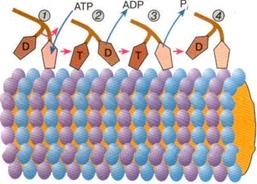
Рис. 7. Схема перемещения молекулы кинезина вдоль тубулиновой микротрубочки,. Буквами Т и D обозначены головки кинезина, с которыми связаны соответственно АТФ или AДФ. В исходном положении (состояние 1 ) головка кинезина, не связанная с микротрубочкой, содержит молекулу AДФ, вторая головка, которая в это время контактирует с микротрубочкой, свободна от нуклеотидов. После связывания АТФ второй головкой изменяется конформация молекулы кинезина, в результате чего первая головка, содержащая AДФ, смещается вправо (переход 1 →2). После диссоциации AДФ свободная головка связывается с микротрубочкой (переход 2 →3). Затем происходят гидролиз АТФ и диссоциация фосфата (Р,), в результате чего головка, с которой связана молекула AДФ отходит от микротрубочки (переход 3 →4). В конечном положении (состояние 4) углы наклона головок кинезина относительно микротрубочки такие же, как в исходном состоянии 1, но при этом молекула кинезина оказалась смещенной вдоль микротрубочки на расстояние, соответствующее двум мономерным звеньям тубулина а и тубулина Р
Как отмечали в выше, тубулиновые микротрубочки цитоскелета состоят из глобулярных белков двух типов (α- и β-тубулин).
По структурным и биохимическим свойствам кинезин напоминает миозин. Молекула кинезина представляет собой димер, образованный двумя одинаковыми полипептидными цепями. Подобно молекуле миозина, с одной стороны каждой полипептидной цепи кинезина формируется глобулярная головка, соединенная со сравнительно длинным хвостом. Линейные размеры головки сравнительно невелики, они составляют 7,5 х 4,5 х 4,5 нм. Хвосты двух мономерных цепей сплетены вместе, а наклоненные в разные стороны головки образуют своеобразную рогатину, которая непосредственно взаимодействует с глобулярными мономерами микротрубочки, вдоль которой перемещается кинезин (рис. 7).
Каждая из двух головок кинезина обладает АТФ-азной активностью. Связывание и гидролиз молекулы АТФ в активном центре кинезина, а также последующие события, вызванные диссоциацией AТФ сопровождаются изменением положения головок относительно тубулиновых мономеров, в результате чего кинезин перемещается вдоль микротрубочки. Работа головок кинезина хорошо скоординирована: связывание и пиролиз молекулы АТФ одной головкой димерного комплекса способствует освобождению молекулы ADP из активного центра другой головки. Головки кинезина попеременно связываются с мономерными звеньями микротрубочки. На рис. 7 показана одна из наиболее вероятных схем работы кинезина, которая объясняет, каким образом происходит перемещение кинезина вдоль микротрубочек. В ходе структурных перестроек моторных участков кинезина угол наклона головок относительно микротрубочки изменяется, вследствие чего кинезиновый димер смещается вдоль микротрубочки. Это движение по своему характеру напоминает перемещение двуногого существа — головки кинезинового димера попеременно опираются на тубулиновые глобулы микротрубочки.
Один шаг димерного комплекса приводит к его смещению вдоль микротрубочки на расстояние 8 нм. Длина шага в точности соответствует размеру двух мономерных глобул (a-тубулин и b-тубулин), из которых построена микротрубочка. Одна молекула кинезина обычно совершает не менее 100 шагов, прежде чем она отделяется от микротрубочки. Кинезин движется с поразительно быстрой скоростью. За одну секунду он делает приблизительно 100 шагов, перемещаясь за это время на расстояние 800 нм. При этом сила, развиваемая одной молекулой кинезина, составляет величину F = 6 пН. Если бы такой мощностью в расчете на единицу массы обладали автомобильные моторы, то они могли бы легко разгонять машины до скоростей, существенно превышающих скорость звука. Коэффициент полезного действия кинезинового мотора также велик. Совершаемая им за один шаг работа равна DW= FDl = 48 пН × нм, что составляет около 60% от энергии, выделяемой при гидролизе одной молекулы АТФ. Работая в качестве индивидуального молекулярного извозчика, кинезин может совершать перемещения на очень большие расстояния (до 1 мм).
Как видно из вышеизложенного, перемещение живых систем и их компонетов в пространстве осуществляется путем взаимодействия различных типов белковых молекул, так называемых механохимических белков. Для генерации движения эти молекулы используют энергию или трансмембранного потенциала (у прокариот), или гидролиза молекул АТФ. В последние годы, в клетках различных организмов, обнаружено большое количество белковых молекул, ответственных за сократительную активность, подвижность и транспортные процессы в клетке. Одних только механохимических белков типа миозина в клетках различных организмов насчитывается более 15 семейств и свыше 84 видов. Важным достижением в исследовании молекулярных моторов явилась разработка новых биофизических методов регистрации подвижности белков, которые позволили непосредственно наблюдать за движением отдельных моторных белков и их фрагментов.
Дата добавления: 2018-03-02; просмотров: 808;
