Движение эукариотических клеток
Перемещение одноклеточных эукариот в пространстве определяется развитой сетью белковых филаментов цитоплазмы, которые образуют опорно-двигательный аппарат клетки ( цитоскелет). Эти белковые филаменты условно можно разделить на три типа: микрофиламенты (d ~ 5 нм), промежуточные филаменты (d ~ 10 нм), микротрубочки (d ~ 25 нм).
Микрофиламенты представляют собой полимерные белковые тяжи, мономером которых являются глобулярные белки. Основным компонентом этих структур является белок актин с м.м. 42 кДа. С актиновыми филаментами могут взаимодействовать другие белки, например миозин. У экуритотических клетках обнаруживаются протофибриллы длиной до 300 нм, мономером которых являются миозиновые молекулы. Такие протофибриллы взаимодействуют с актиновыми микрофиламентами при генерации амебоидного движения. В циоскелете обнаружен также немышечный тропомиозин, филамин, α –актинин. Они участвуют в образовании гибких связей между микрофиламентами, в результате чего формируется трехмерная сетчатая структура цитоскелета.
Промежуточные филаменты цитоскелета выполняют главным образом структурную функцию и представляют собой полимерные белки. В различных типах эукариотических клеток обнаружены промежуточные филаменты, состоящие из разных белковых молекул. Например, эпителиальные клетки содержат кератиновые филаменты, которые состоят из креатиподобных белков с м.м. от 40 до 65 кДа. Нейроны содержат нейрофиламенты, состоящие из трех типов белков с м.м. 68, 145, 220 кДа. В фибробластах промежуточные филаменты построены из белка виментина с м.м. 55 кДа.
Микротрубочки- основные сократительные элементы ресничек и жгутиков одноклеточных эукариот. Они представляют собой полые цилиндры с наружным диаметром около 25 нм, внутренним- 15 нм. Длина микротрубочек может составлять несколько микрометров. Микротрубочки состоят из димерного белка тубулина с м.м. 110 кД. Каждый димер включает две молекулы глобулярных белков: α –тубулина и β -тубулина с м.м. каждой глобулы 55 кД. При соответствующих условиях мономеры тубулина полимеризуются, образуя длинные полимерные структуры. Сначала образуется димерная молекула, а затем α –тубулин одного димера соеденяется с β –тубулином другого димера, образуя длинные тяжи – протофибриллы. Несколько протофибрил объединяются, сворачиваются , образуя замкнутые и незамкнутые цилиндры. Например, субфибрилла А жгутика эукариот является замкнутой микротрубочкой, состоящим из 13 протофибрилл. Незамкнутые микротрубочки (субфибрилла В) состоят из 10 протофибриллярных тяжей.
Микротрубочки и филаменты образуют в клетках эукариот динамическую взаимосвязанную сеть, которая находится под контролем клетки и обеспечивает изменение ее формы, различные виды клеточной подвижности и внутриклеточный транспорт веществ.
Создаваемое этими структурами движение одноклеточных эукариот и некоторых клеток многоклеточных организмов в пространстве, реализуется в основном двумя способами: при помощи ресничек и жгутиков или амебоидным способом.
Движение при помощи ресничек и жгутиков – наиболее распространенная форма подвижности одноклеточных организмов в жидкой среде. Реснички и жгутики это белковые образования диаметром до 250 нм , длина их может достигать нескольких микрометров. Генерация движения в этих образованьях осуществляется комплексом, состоящим из микротрубочек и вспомогательных белков. Ультраструктура ресничек и жгутиков у различных типов клеток в основном сходна, однако, по способу движения они различаются. Например, жгутик спермотозоонов и многих простейших производит волнообразные движения, по всей длине жгутика распространяются симметричные волны изгибания в направлении от базальной части к вершине жгутика. В отличие от жгутика, ресничка совершает гребные движения. Цикл движения реснички длится 0,1-0,2 с и состоит из фазы упругого удара и возвратного удара. При упругом ударе ресничка в выпрямленном состоянии проталкивает жидкость вдоль поверхности клетки. При возвратном ударе ресничка расслабляется и, изгибаясь, возвращается в исходное положение. Движение осуществляется за счет синхронной работы многочисленных ресничек на поверхности клетки. По механизму движения такую клетку можно сравнить с лодкой с многовесельным экипажем.
Генерация движения ресничек и жгутиков происходит в аксонеме. Аксонема находится у основания жгутика и представлена она комплексом взаимосвязанных микротрубочек и отдельных белковых молекул(рис. 2). В центре аксонемы располагаются две микротрубочки, окруженные центральной оболочкой. На периферии находится 9 пар микротрубочек, соединеных между собой поперечными нексиновыми мостиками (белок нексин с м.м. 165 кДа). Каждая периферическая пара состоит из двух типов микротрубочек А и В. Субфибрилла А представляет собой полый цилиндр, а микротрубочка В имеет серповидную (незамкнутую) форму и открытой частью примыкает к субфибрилле А. Каждая субфибрилла А имеет двойной ряд боковых динеиновых ручек длиной около 14 нм (белок динеин с м.м. 400 кДа). Из субфибриллы А в сторону центральной части выступают радиальные спицы. Все эти белковые структуры расположены вдоль периферических субфибрилл через определенный интервалы: динеиновые ручки – через 24 нм, радиальные спицы – через 29 нм, нексиновые мостики- через 86 нм.
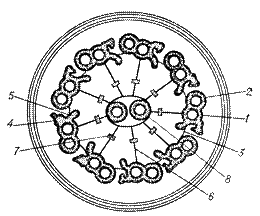 Аксонема — основной структурный элемент реснички и жгутика.
Аксонема — основной структурный элемент реснички и жгутика.
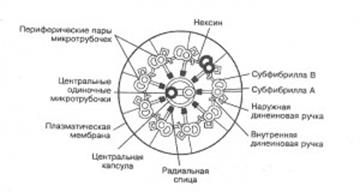
Рис.2. Схематичное изображение строения аксонемы жгутика эукариотических клеток.
а - продольный срез; б- поперечный срез
1 –центральные микротрубочки; центральная оболочка; 3 – динеиновые ручки; 4- радиальные спицы; 5 - субфибрилла А; 6 - субфибрилла Б; 7- нексиновые мостики; 8 – плазмалемма.
Аксонема генерирует движение жгутика за счет активного скольжения периферических микротрубочек относительно центрального дублета. Для движения используется энергия АТФ. Скольжение микротрубочек происходит за счет изменения конформации динеиновых ручек, которые обладают АТФ-азной активностью. Нексиновые ручки закрепляют периферические субфибриллы друг другу и поэтому они смещаются как единое целое относительно центральной части аксонемы. Так как основание жгутика (реснички) закреплено на мембране, скольжение микротрубочек приводит к изгибанию хвостовой части. Показано, что причиной одной из форм бесплодия человека является неподвижность сперматозоидов, из-за отсутствия динеиновых ручек в аксонеме.
Амебоидное движение характерно для амеб и некоторых типов клеток животных тканей, например, фагоцитов, фибробластов. Этот тип движения возможно только при перемещении по плотной поверхности. Оно связано с изменением структуры (состояния) цитоплазмы, называемое как переходы гель ↔ золь, которое обусловлено полимеризацией и деполимеризацией актиновых филаментов. Жидкое состояние цитоплазмы (золь) перетекает из центральной части клетки на периферию, образуя выросты – псевдоподии. Закрепление псевдоподии на субстрате происходит при полимеризации актина, образовании микрофиламентов и их сшивка (состояние геля). При взаимодействии микрофиламентов, прикрепленных к мембране, с миозином происходит их скольжение, в результате чего мембрана сдвигается и образует псевдоподии. Этот процесс происходит с участием ионов Са2+ и требует затраты энергии АТФ. Переход из состояния гель в состояние золь происходит самопроизвольно и обуславливается деполимеризация актиновых нитей. Таким образом, воснове амебоидного движения лежит циклический процесс полимеризации и деполимеризации актиновых филаментов.
.
Мышечное движение
Мышечное сокращение является примером работы высокоспециализированной машины, превращающей энергию химических связей в механическую работу. Мышечная ткань своими сокращениями создают движение всего тела, конечностей, органов, тканей. По строению и выполнению функций мышечная ткань разделяется на гладкие, исчерченные (поперечно-полосатые) и сердечные мышцы. Рассмотрим структуру и механизм работы мышц на примере поперечно-полосатых мышц.
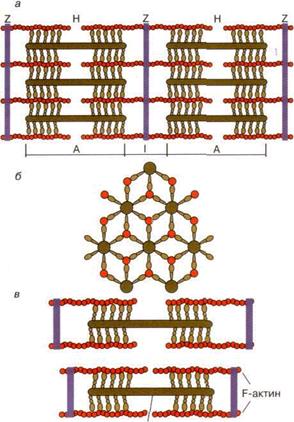
Мышцы состоят из специализированных клеток – мышечных волокон. Мышечное волокно представляет собой многоядерную клетку цилиндрической формы диаметром 20 – 80 мкм, длина может достигать до 100 см и более, например, у крупных млекопитающих. В мышечной ткани волокна объединены в пучки, по 20 – 50 штук в пучке. Пучки между собой разделены тонкой оболочкой из соединительной ткани, состоящей из коллагеновых и эластиновых волокон. Плазматическая мембрана мышечной клетки называют сарколеммой, цитоплазму – саркоплазмой. В саркоплазме мышечной клетки находится несколько ядер, и другие органоиды (митохондрии, рибосомы). Кроме того, в саркоплазме располагаются специализированные сократительные структуры мышечной клетки – миофибриллы. Миофибриллы представлены белковыми нитями диаметром 1-2 мкм, расположенными параллельно друг другу и тянущиеся от одного конца клетки до другого. В одной клетке их число может составлять до 2000 штук. Миофибрилла представляет из себя комплекс из толстых и тонких протофибрилл. Высокая упорядоченность расположения этих структур обуславливает поперечно-полосатую исчерченность мышц, наблюдаемых в электронный микроскоп. Структурно-функциональными единицами миофибрилл являются саркомеры, которые располагаются вдоль мышечных волокон через каждые 2 - 3 мкм. Саркомер состоит из параллельных рядов толстых и тонких нитей. Взаимное расположение толстых и тонких нитей саркомера схематически показано на рис. 3, а. Вертикальные темные линии Z соответствуют специальным структурным белкам, разделяющим миофибриллы на саркомеры. Между ними видны горизонтальные нити сократительного аппарата. От Z-линий отходят тонкие нити, которым на электронно-микроскопических снимках соответствуют светлые полосы I.
миозин
Рис. 3. Схематическое изображение миофибрилл мышечного волокна:
а - продольный разрез, б - поперечный разрез в области пересечения толстых и тонких нитей, в - изменение длины саркомера в результате движения толстых и тонких нитей
В центральной части саркомера расположены толстые нити, которым соответствуют темные полосы А. В середине каждой А-полосы видна более светлая полоса Н. Наличие двух темных участков полосы А определяется тем, что в этих зонах толстые нити перекрываются с тонкими нитями. Соседние миофибриллы в мышечном волокне располагаются так, что Z-линии находятся на одном уровне. Более светлая полоса (Н-зона) соответствует участку саркомера, где толстыенити не перекрываются с тонкими нитями.
Толстые нити, имеющие диаметр 15 нм, состоят в основном из молекул миозина. Тонкие нити диаметром 9 нм содержат белковые молекулы трех основных типов : актин, тропомиозин и тропониновый комплекс. При рассмотрении поперечного срез саркомера в области, где соседствуют толстые и тонкие нити (темный участок полосы А), то можно увидеть, что каждая тонкая нить окружена тремя толстыми нитями, а каждая толстая нить окружена шестью тонкими нитями (рис. 1, б).
Толстые и тонкие нити взаимодействуют друг с другом с помощью поперечных мостиков длиной около 13 нм, которые через регулярные промежутки выходят из толстых нитей и образуют связи между соседними толстыми и тонкиминитями.
При сокращении мышцы ее длина может уменьшаться на 40 %. В настоящее время доказано, что сокращение мышечного волокна достигается за счет движения толстых и тонких нитей относительно друг друга. Такой механизм мышечного сокращения («модель скользящих нитей» ) был предложен в 50-х годах 20 века. В основе этой модели лежат следующие факты:
• при сокращении мышцы длины толстых и тонких нитей миофибриллы не изменяются;
• происходит укорачивание саркомера счет перекрывания толстых и тонких нитей, которые скользят друг относительно друга во время сокращения мышцы. Это проявляется в том, что при сокращении мышцы полосы Н и I укорачиваются (рис. 1, в);
• сила, развиваемая мышцей, создается в процессе движения толстых и тонких нитей протофибриллы.
Скольжение толстых и тонких нитей друг относительно друга совершается за счет энергии гидролиза АТФ. АТФ-азная активность миозина была открыта в 1939 году супругами В.А. Энгельгардтом и М.Н. Любимовой. Ими было также показано, что добавление АТР к белковому препарату, состоящему из нитей миозина, влияет на его механические свойства. Впоследствии было показано, в растворе актин и миозин образуют так называемый актомиозиновый комплекс. Интересно отметить, что свободный миозин слабо гидролизует АТФ, а в присутствии актина его АТФ-азная активность возрастает до 200 раз.
Миофибриллы мышечных клеток построены из молекул белков, которые составляют около 12 % сухой массы мышечной клетки. К настоящему времени в составе миофибрилл обнаружены несколько десятков сократительных белков. Большая часть белков представлена двумя основными белками: миозином (55 % массы всех белков) и актином (20 %). Другие белки в мышечной клетке представлены в меньших ( минорных) количествах: тропомиозин (7 %), тропонин (2 %), актинин (10 %) . Основным структурообразующим белком толстых нитей мышечного волокна является миозин. Эта молекула представляет собой димер, образованный из двух сплетенных друг с другом одинаковых мономеров миозина (рис. 2, а). Каждый из этих мономеров состоит из одной тяжелой цепи (230 кДа) и двух легких цепей с молекулярной массой около 20 кДа. На одном конце миозина полипептидные цепи свернуты в глобулы, и образуют своеобразную "головку" миозина (фрагмент S1). С помощью более тонкой шейки (фрагмент S2) головки миозина соединяется с длинным хвостом, который образован протяженной полипептидной цепью, уложенной в виде вытянутой a-спирали.
Хвосты двух мономерных единиц миозина сплетены друг с другом и образуют вытянутый стержень длиной 170 нм и толщиной 2 нм. Таким образом, миозин скелетных мышц (миозин класса II) является крупным белком, состоящим из шести полипептидных цепей.
Моторный фрагмент миозина (S1) непосредственно взаимодействует с тонкой актиновой нитью. Фрагмент S1 включает в себя каталитический центр, с которым связывается молекула АТФ и где происходит ее гидролиз. В ходе реакции гидролиза АТФ выделяется энергия, за счет которой работает миозин. Согласно данным Айвэна Рэймента с сотр. (1993) , фрагмент S1 представляет собой глобулу размером 16,5 х 6,5 х 4 нм. Вращательная подвижность головки миозина обеспечивается за счет шарниров, которые представляют собой гибкие участки полипептидной цепи. Один из них находится в месте соединения фрагментов S1 и S2, Другой расположен между фрагментом S2 и хвостом миозина (рис. 2, я). Наличие молекулярных шарниров дает возможность фрагменту S1 присоединяться и отсоединяться от нити актина, а также изменять свою ориентацию в ходе сократительного цикла (рис. 3,4). Функционально важным звеном молекулы миозина является ее регуляторный участок, расположенный в области шейки, соединяющей каталитическую головку с хвостом молекулы миозина. Шейка образована α-спиралью полипептидной цепи длиной 8—9 нм, которая окружена двумя легкими полипептидными цепями S2.
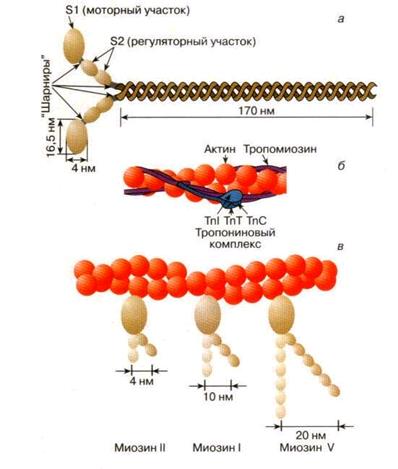
Рис. 4. Строение толстой (а) и тонкой нити (б) миофибриллы,
В саркомерах поперечнополосатых мышц каждая толстая нить состоит приблизительно из 300 сплетенных димеров миозина. С обоих концов толстой нити выступают многочисленные подвижные мостики (головки), которые могут связываться с окружающими их тонкими нитями актина (рис. 3, б). Кроме миозина, в толстой протофибрилле обнаружены минорные белки с м.м. 140 кДа, 64 Кда, 50 кДа. В зоне М-полосы содержится креатикиназа (м.м. 80 кДа), М-белок (м.м. 165 кДа), миомезин (м.м. 185 кДа).
Тонкие нити мышечных волокон также состоят из нескольких белков (рис. 4, б). Основным белком тонкой протофибриллы является фибриллярный белок F-актин. F-актин представляет собой полимерный белок, состоящий из мономеров глобулярного белка G-актина с диаметром глобул около 6 нм. В свою очередь, мономер G-актина состоит из 374 остатков аминокислот и имеет молекулярную массу 42 кДа. Полимеризация G-актина происходит с участием АТФ в присутствии Mg2+. При этих условиях мономеры G-акгина, образуют вытянутые линейные полимерные цепи диаметром 6—7 нм, называемые микрофиламентами. Тонкая протофибрилла образована из двух цепей F-актина, скрученных между собой с периодом 73-74 нм. Тонкие протофибриллы, с которыми взаимодействуют миозиновые мостики, содержат еще один фибриллярный белок- тропомиозин (Тм) с м.м. 68 кД и три белка тропонинового комплекса (ТnС, ТnI и ТnТ). По своей массе они составляют приблизительно треть от всей массы тонких нитей. Три типа белковых молекул находятся в составе тонкой протофибриллы в определенном соотношении: на 7 молекул G-актина приходится по одной молекуле Тм, ТnС, ТnI и ТnТ.
Молекула тропомиозина состоит из двух вытянутых a-спиралей длиной около 38 нм. Эти молекулы располагаются в бороздках спирали актиновой нити и взаймодействуют между собой и белками тропомиозинового комплекса. Белок ТnТ непосредственно связан с тропомиозином, а белок ТnI - с актином. Белок ТпС принадлежит к классу регуляторных белков, называемых кальмодулинами. Этот белок активируется при связывании четырех ионов Са2+. Кроме этих основных белков, тонкая нить содержит еще минорные белковые компоненты. На концах тонких протофибрилл находится белок β-актинин (м.м. 180 кДа), который блокирует дальнейшую полимеризацию F-актина. Из области Z- диска выделены белки α-актинин, филамин (м.м. 240 кДа), десмин (м.м. 50 кДа). Эти белки образуют поперечные мостики между актиновыми нитями различных саркомеров и крепят их к Z- диску.
Дата добавления: 2018-03-02; просмотров: 3978;
