Требования к ферментам, используемым в клинико-биохимических исследованиях.
1. Органоспецифичность.
2.Низкая активность в крови в норме.
3. Выход в кровь только при повреждении соответствующего органа.
4. Высокая стабильность в крови (не менее 1-2 часов).
5. Доступная методика определения активности фермента.
Каскады, циклы и цепи химических реакций, лежащих в основе процессов жизнедеятельности, катализируются ферментами, без участия которых жизнь невозможна. Они – основа здоровья и болезней. Нарушение функции даже одного из них влечет за собой значительные нарушения последующих и сопряженных реакций. Определение активности внутриклеточных ферментов, поступающих при патологических процессах в межклеточную жидкость и кровь, широко используется локализации патологического процесса и степени его развития. Во многих случаях ферменты – это лекарственные препараты, необходимые для лечения. В лабораторной практике они нашли применение как реактивы для количественного определения отдельных органических веществ в сложных смесях с другими соединениями.
В диагностике заболеваний определению активности ферментов придается большое значение. Оптимальные условия проведения ферментативной реакции:
1) установление рН-оптимума фермента путем использования соответствующего буферного раствора с гарантией поддержания рН на постоянном уровне во время реакции;
2) удаление из зоны реакции ингибирующих веществ;
3) поддержание постоянной температуры во время проведения реакции;
4) добавление в достаточном количестве коферментов;
5) обеспечение избытка субстрата.
Избыток субстрата гарантирует измерение максимальной скорости реакции и устраняет падение активности фермента из-за потребления субстрата. Условия проведения реакции должны строго соблюдаться. Помимо определения активности ферментов с диагностической целью, имеет значение и определение количества субстратов с помощью препаративно изолированных ферментов. Для этого к определенному субстрату добавляют избыток фермента в оптимальных для реакции условиях. Затем полученный продукт определяют специальными методами.
Например, использование фермента в реакциях превращения глюкозы основано на свойстве субстратной специфичности и исключает участие в химической реакции других сахаров. В этом случае определяется концентрация только глюкозы. Ферментативными методами определяют концентрацию ТАГ, мочевины, холестерина и др. субстратов.
Ферменты неравномерно распределены внутри клеток. Они связаны с определенными структурами и местами в клетке, которые выполняют определенную роль в обмене веществ и тесно взаимосвязаны друг с другом. Многие ферменты тесно связаны со структурными белками в данном отсеке клетки. В некоторых случаях едва ли возможно различить белок фермента и структурный белок. Такая жесткая фиксация ферментов со структурными образования клетки характерна не для одного, а для целой группы ферментов, которые катализируют цепь метаболических превращений. Ферменты и структурные белки тесно связаны в митохондриях. Во внутренней мембране локализованы функциональные единицы – комплексы ферментов дыхательной цепи и окислительного фосфорилирования. Они обеспечивают получение и накопление энергии. Комплексы реакций окисления жирных кислот и цикла Кребса протекают также в митохондриях. Таким образом, в митохондриях сосредоточен целый ряд мультиферментных комплексов. Тесный контакт ферментов и субстратов в мультиферментных комплексах благоприятствуют быстрому протеканию реакций.
Первичные лизосомы, пузырьковые образования, содержимое которых состоит из ферментов, катализирующих распад клеточных составных частей. Неконтролируемое действие этих ферментов после разрушения первичных лизосом может привести к растворению клетки. В нормальных условиях действие лизосомных ферментов контролируется. При повреждении клеток и после их гибели ферменты выходят из первичных лизосом и вызывают растворение клетки (аутоцитоз). Мембраны ЭПС содержат ферменты для синтеза ТАГ и сложных липидов.
Гиалоплазма (цитозоль) – жидкое содержимое клеток, которое омывает все органеллы и заключено в мембрану. Там происходит синтез и распад углеводов, синтез жирных кислот, ряд подготовительных реакций для получения энергии в митохондриях.
Роль коферментов могут выполнять различные соединения: коферменты – нуклеотиды, коферменты – металлы, коферменты – производные водорастворимых витаминов, липоевая кислота, убихинон. Особо важное значение имеют коферменты – производные водорастворимых витаминов, так как протекание реакций, катализируемых ферментами с такими коферментами, зависит от поступления витаминов с пищей.
Коферменты, содержащие тиамин, образуются путем фосфорилирования витамина В1. Хорошо установлена роль тиаминдифосфата, известного также под названием тиаминпирофосфат (ТПФ), или кокарбоксилаза. Он участвует в реакциях простого окислительного декарбоксилирования альфа-кетокислот, входит в состав транскетолазы (пентозофосфатный путь окисления глюкозы).
Коферменты, содержащие пантотеновую кислоту (витамин В5). Пантотеновая кислота входит в состав кофермента А (КоА-SН). Этот кофермент участвует в реакциях переноса остатка кислоты (ацила). Наиболее значим в клетках остаток уксусной кислоты – ацетил. Ацетил – кофермент А (СН3-СО~S-КоА) – это соединение, которое объединяет между собой обмен разных веществ в клетке.
Коферменты, содержащие витамин РР (никотинамид, витамин В3). Витамин РР входит в состав НАД и НАДФ, которые входят в состав дегидрогеназ, катализирующих окислительно-восстановительные реакции. Они выполняют роль промежуточных акцепторов электронов и протонов.
Коферменты, содержащие рибофлавин. Они образуются путем фосфорилирования или аденилирования витамина В2. Различают 2 кофермента, содержащих рибофлавин – ФМН и ФАД – они участвую в окислительно-восстановительных реакциях. Коферменты образуются путем фосфорилирования двух производных пиридина – пиридоксаля и пиридоксамина. Ведущим коферментом является пидоксальфосфат, участвующий в реакциях трансаминирования, декарбоксилирования и др.
Коферменты, содержащие витамин Вс. (фолиевая кислота), в своем составе витамин Вс содержит еще один витамин – парааминобензойную кислоту, которая соединяется с птеридином и глутаминовой кислотой. Коферментной формой является тетрагидрофолиевая кислота, которая участвует в реакциях переноса фрагментов органических молекул, содержащих один углеродный атом, необходимых для синтеза нуклеотидов, аминокислот, липидов.
Коферменты, содержащие витамин В12, который входит в состав коферментов – метилкобаламин и 5´-дезоксиаденозилкобаламин.
Метилкобаламин участвует в реакциях переноса метильных групп, которые становятся важными источникамиодноуглеродных фрагментов, а 5´-дезоксиаденозилкобаламин участвует в реакциях изомеризации.
Биотин (витамин Н) образует активную форму – карбоксибиотин, который участвует в реакциях карбоксилирования и транскарбоксилирования.
Коферменты – производные водорастворимых витаминов приобретают большое значение еще и потому, что в их состав входят вещества, которые не могут синтезироваться клетками человека и многих животных. Поэтому протекание реакций, катализируемых ферментами, в состав коферментов которых входят витамины, зависит о поступления витаминов с пищей.
В клинической практике широко используется определение активности двух трансаминаз. В диагностике инфаркта миокарда применяют определение активности аспартат-аминотрансферазы (АсАТ), а для диагностики и оценки эффективности лечения некоторых болезней печени используют определение активности аланин-аминотрансферазы (АлАТ), что связано с неравномерным распределением этих ферментов в разных органах и тканях и даже в разных субклеточных фракциях (табл.).
Таблица.
Относительное распределение активности ферментов АсАТ и АлАТ
(в условных единицах)
| АсАТ | АлАТ | |
| Сердце Печень Почки Эритроциты Лёгкие Плазма |
Две трети всей активности АсАТ клетки приходятся на митохондрии, а для АлАТ – на цитоплазму. При незначительных нарушениях функций клетки в кровь переходят цитозольные ферменты. При значительных повреждениях в кровь могут переходить митохондриальные ферменты. Учёные обратили внимание на значение определения активности трансаминаз при инфаркте ещё в 1954 г. Активность АсАТ повышалась через 2-6 ч после инфаркта, достигала максимума через 24-48 ч и затем в течение недели возвращалась к исходным значениям. Несомненно, ЭКГ – более эффективное средство диагностики, чем определение активности АсАТ. Однако при диагностике повторных инфарктов, определение активности АсАТ оказывает хорошую помощь в диагностике.
При острых поражениях печени типичным будет повышение активности АлАТ, а также и других ферментов (АсАТ, ЛДГ), однако коэффициент АсАТ/АлАТ будет меньше единицы. При инфаркте миокарда активность АсАТ значительно увеличивается и АсАТ/АлАТ > 1. Повышение активности АлАТ обычно наблюдается при повреждении паренхиматозных клеток печени (повреждения клеток вызывают вирусы, грибные яды, этанол). Активность АлАТ повышается к 3-м суткам и поддерживается на повышенном уровне в течение 30-40 дней. При поражении желчевыделительных путей активность АлАТ обычно повышается незначительно.
АсТ-белок с М = 111000 Д
АсТ представлена отдельными изоэнзимами, составляющими две основные формы фермента – митохондриальную и растворимую, содержащиеся как в митохондриях, так и в цитоплазме.
Митохондриальная форма энзима составляет около 12% общей активности АсТ. В печени на долю митохондриальной формы АсТ приходится 81% от общей активности фермента (ц-АсТ – растворимая в цитозоле, м-АсТ – митохондриальная).
Ц-АсТ представлена двумя идентичными субъединицами, являясь димером с молекулярной массой 93 кД.
Наиболее богатыми источниками АсТ являются сердце, печень, скелетная мускулатура, нервная ткань и почки; в поджелудочной железе, селезёнке и лёгких АсТ обнаруживается в меньших количествах.
Аспартат-аминотрансфераза обратимо катализирует реакцию:
COOH COOH COOH COOH
| | | |
HC – NH2 C = O C = O CH – NH2
| | АсТ | |
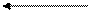 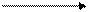 CH2 + CH2 CH2 + CH2
| | | |
COOH CH2 COOH CH2
| |
COOH COOH
α-аспартат α-кетоглутарат ЩУК α-глутамат CH2 + CH2 CH2 + CH2
| | | |
COOH CH2 COOH CH2
| |
COOH COOH
α-аспартат α-кетоглутарат ЩУК α-глутамат
|
АлТ является второй важной аминотрансферазой, выделенной из тканей человека и хорошо изученной. АлТ присутствует во многих органах: печени, почках, скелетных мышцах, миокарде, поджелудочной железе. АлТ присутствует в клетках в форме двух изоферментов – цитозольного и митохондриального, но последний является нестабильным, да и содержание его в клетках низкое.
Аланинаминотрансфераза обратимо катализирует реакцию:
COOH COOH
| |
COOH C = O COOH CH – NH2
| | АлТ | |
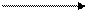 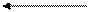 CH – NH2 + CH2 C = O + CH2
| | | |
CH3 CH2 CH3 CH2
| |
COOH COOH
α-аланин α-кетоглутарат пируват α-глутамат CH – NH2 + CH2 C = O + CH2
| | | |
CH3 CH2 CH3 CH2
| |
COOH COOH
α-аланин α-кетоглутарат пируват α-глутамат
|
Дата добавления: 2018-03-01; просмотров: 1753;
