Специфичность по отношению к реакции
Каждый фермент катализирует одну реакцию или группу реакций одного типа. Часто одно и то же химическое соединение выступает как субстрат для разных ферментов, причем каждый из них, катализируя специфическую для него реакцию, приводит к образованию разных продуктов.
Например:
H
 [О] [О]
      R C COOH R C COOH+NH3 R C COOH R C COOH+NH3
   оксидаза
NH2 O
декарбоксилаза оксидаза
NH2 O
декарбоксилаза
 R CH2 + CO2 R CH2 + CO2
 NH2
NH2
|
Специфичность к типу реакции лежит в основе единой классификации ферментов.
По строению различают: простые ферменты (при гидролизе образуются только аминокислоты), сложные (при гидролизе образуются аминокислоты и добавочные группы.
Белковая часть фермента называется – апофермент,не белковая – кофактор.Прочный природный комплекс апофермента и кофактора, называют холофермент.
Типы кофактора:
а) простетическая группа – прочна связанная с апоферментом не белковая часть, часто связь ковалентная и в качестве не белковой части выступают металлы;
б) кофермент – не белковая часть, легко отделяемая от апофермента, рыхло связанная с ним. Часто коферментами служат витамины.
У каждого фермента имеется активный центр.
Активный центр фермента образован:
Простые ферменты: функциональными группами боковых радикалов аминокислот, сближенных в пространстве.
Сложные ферменты: + кофактор.
Примеры функциональных групп активного центра:
NH2 – лиз OH – сер
COOH – глу, асп SH – цис
Участки активного центра:
- Якорный – для фиксации субстрата;
- Каталитический –обеспечивает катализ.
У ряда регуляторных ферментов имеется ещё один центр – аллостерический- это центр, занимающий другое пространственное положение, чем активный центр. Присоединение к этому центру низкомолекулярных веществ – эффекторовведет к изменениютретичной структуры фермента и области активного центра, что приводит к изменению активность фермента.
Хотя фермент обычно катализирует одну реакцию, в организме имеются белки, которые катализируют схожие реакции. Такие белки, которые обладают способностью катализировать одинаковые реакции, но отличаются физико – химическими и биохимическими параметрами (электрофоретическая подвижность, рН – оптимум, чувствительность к ингибиторам) относят к множественным формам ферментов. Различают два основных вида множественных ферментов. Один вид называют изоферментами – это молекулярные формы ферментов, синтез которых контролируется различными генами, а следовательно, первичные структуры их различны, различаются также по аминокислотной последовательности, молекулярной массе, аминокислотному составу и др. Например, окисление молочной кислоты (лактат) в организме катализирует фермент ЛДГ – лактатдегидрогеназа. Под ЛДГ понимают 5 различных ферментов, которые обозначаются цифрами от 1 до 5 – ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5. Большое число изоферментов обусловлено субъединичным их строением. Молекула ЛДГ состоит из 4 полипептидных цепей, формирующих четвертичную структуру фермента.
У человека синтезируются две разные по составу ЛДГ – полипептидные цепи, которые позволяют на уровне четвертичной структуры создавать пять различных комбинаций. Это их количество обусловлено наличием двух генетических локусов, которые кодируют синтез 2-х олигомеров субъединицы M (muscle) и субъединицы Н (heart). Соединяясь в тетрамеры, субъединицы образуют 5 изоформ:

 НННН – ЛДГ1 НННН – ЛДГ1
 преобладают в сердце, мозге, почках.
НННМ - ЛДГ2
ННММ - ЛДГ3 - преобладает в легких. преобладают в сердце, мозге, почках.
НННМ - ЛДГ2
ННММ - ЛДГ3 - преобладает в легких.

 НМММ - ЛДГ4 НМММ - ЛДГ4
 преобладают в печени и скелетной мускулатуре.
ММММ - ЛДГ5 преобладают в печени и скелетной мускулатуре.
ММММ - ЛДГ5
|
Среди других ферментов, имеющих изоформы – это креатинкиназа (три изоформы), щелочная фосфатаза (2 изоформы) и др. Так как изоферменты имеют различную локализацию в тканях, то это имеет важное значение для диагностики различных заболеваний. У больных острым инфарктом миокарда резко повышается активность ЛДГ1 и отчасти ЛДГ2.
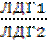 > 1.
> 1.
Международный биохимический союз разработал единые требования к названиям ферментов и единую классификацию. В основе классификации лежит химическая характеристика реакций, катализируемых ферментами или химическая природа субстрата, подвергающегося превращению. Выделяют 6 классов.
1. Оксидоредуктазы – катализируют окислительно – восстановительные реакции (дегидрогеназа, оксигеназы, оксидазы). Например, ЛДГ обеспечивает окисление и восстановление молочной кислоты; ксантиноксидаза катализирует синтез мочевой кислоты.
2. Трансферазы – катализируют перенос групп между субстратами (аминотрансферазы: АсТ, АлТ и др.).
3. Гидролазы – катализируют реакции расщепления при участии воды (пепсин, трипсин).
4. Лиазы – катализируют реакции отщепления групп с образованием двойных связей или присоединением групп по месту двойных связей. Например, декарбоксилазы – катализируют отщепление CO2.
5. Изомеразы - катализируют реакции внутримолекулярной перестройки. Например, глюкозофосфатизомераза обеспечивает прямую и обратную реакцию между фруктозо – 6 – фосфатом и глюкозо – 6 – фосфатом.
6. Лигазы (синтетазы) – участвуют во всех реакциях синтеза (трансляция белка – синтетаза ДНК–аза, РНК–аза и др.)
Название фермента составляется по названиям субстрата, кофермента, типа реакции:
Глюкозо – 6 – фосфат - фосфогидролаза
   
   Субстрат продукт тип окончание
реакции реакции «аза»
(H3PO4)
Субстрат продукт тип окончание
реакции реакции «аза»
(H3PO4)
|
Старые названия, прочно укоренившиеся в литературе: пепсин, амилаза, трипсин и др.
Международный союз биохимиков опубликовал каталог ферментов, в котором отдельные ферменты расположены по классам и подклассам, с указанием шифра. Например, ЛДГ, новое название НАД+ - оскидоредуктаза (к. ф. 1.1.1. 27).
Дата добавления: 2018-03-01; просмотров: 886;
