Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
Основные положения сложного катализа в химико-технологических процессах нефтехимического синтеза
Катализом называется изменение скорости химических реакций под действием особых ускорителей – катализаторов.
Катализ – явление физико-химическое, темно связанное со скоростью и с механизмом химических реакций. Практическое значение катализа очень велико. Его применение давно стало необходимостью в нефтехимической и химической промышленности, в производстве синтетических каучуков и смол, смазочных веществ, растворителей, лекарственных препаратов и
т. д.
Основные положения науки о катализе:
Ø катализатором является вещество, которое ускоряет определенную реакцию, непосредственно участвуя в ней, но после окончания реакции выделяется вновь в неизменном виде;
Ø катализатор лишь ускоряет реакцию, но не смещает термодинамического равновесия в сторону образования целевого продукта.
Количество катализатора, необходимое для изменения скорости реакции, всегда очень невелико. Действие катализатора специфично, он изменяет скорость только одной какой-то реакции или группы однотипных реакций.
Таким образом, ускоряя одну из возможных реакций, катализатор способствует увеличению селективности (избирательности) по целевому продукту.
В ряде процессов применение катализаторов разного действия позволит получить со значительным выходом различные продукты. Например, окисление этилена на серебряном катализаторе лежит в основе производства оксида этилена, а на палладиевом катализаторе значителен выход ацетальдегида.
Основные группы каталитических процессов:
Ø гомогенные;
Ø гетерогенные;
Ø ферментативные.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе (газовой или жидкой). При гетерогенном катализе катализатор и реагенты или продукты реакции находятся в разных фазах (обычно применяют твердые катализаторы). При ферментативном катализе катализатор находится в коллоидном состоянии.
Ферментативные каталитические процессы протекают в биологических системах под воздействием ферментов.
Теория промежуточных соединений в катализе и их термодинамические и кинетические аспекты
Сущность катализа заключается в образовании промежуточных активированных комплексов субстрата с катализатором. Это вызывает перераспределение электронной плотности в молекуле субстрата и делает ее реакционноспособной.
Любой каталитический процесс является равновесным процессом. Образование промежуточного активированного комплекса, а затем перегруппировка связей в нем требует затраты энергии активации. Распад промежуточного комплекса связан с увеличением энтропии, т.е. термодинамически возможен и самопроизволен. Использование катализатора способствует либо распаду (разрыхлению) промежуточного комплекса, либо его образованию. И то, и другое приводит к увеличению скорости реакции. В гетерогенном катализе образование активированного промежуточного комплекса связано с сорбцией исходных веществ на поверхности катализатора, т.е. с адсорбцией.
Действие катализатора связано с экзотермическим эффектом ∆Н#  адсорбции активированного комплекса на катализаторе.
адсорбции активированного комплекса на катализаторе.
В случае гомогенного катализа
А + В 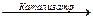 С. (5.1)
С. (5.1)
Вначале образуется промежуточное соединение – субстрат-катализатор:
k1
А + В + Kt ↔ AKt + B, (5.2)
k-1
где Kt – катализатор; k1 и k-1 – константы скорости соответственно прямой и обратной реакций.
Затем происходит образование активированного комплекса со вторым реагентом, константа скорости которого k2:
AKt + B 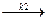 [ AB#] Kt. (5.3)
[ AB#] Kt. (5.3)
В дальнейшем активированный комплекс распадается с выделением катализатора и конечных продуктов реакции, константа скорости которого k3:
[ AB#] Kt 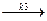 C + Kt. (5.4)
C + Kt. (5.4)
Действие гомогенного катализа в подавляющем большинстве случаев определяется экзотермическим эффектом образования активированного комплекса. В гомогенном катализе скорость реакции прямо пропорциональна концентрации катализатора.
Снижение энергии активации в каталитической реакции может быть связано и с тем, что промежуточные соединения состоят из меньшего числа молекул, чем это необходимо для некаталитической реакции.
Скорость реакции тем больше, чем меньше энергия активации Е, и вследствие экспоненциальной зависимости
k = k0 e-(E/RT) (5.5)
Влияние катализатора на снижение энергии активации можно проиллюстрировать следующими данными: энергия активации некаталитических реакций 125-190 кДж/моль, энергия активации реакций гомогенного и гетерогенного катализа 70-120 кДж/моль, энергия активации реакций ферментативного катализа 35-70 кДж/ моль.
Автокатализ
Автокаталитическиминазываются реакции, в которых катализатором является один из промежуточных или конечных продуктов реакции. Так, в цепных реакциях автокатализаторами служат свободные радикалы. К числу автокаталитических относятся некоторые реакции разложения взрывчатых веществ, горения, полимеризации и другие.
Для автокатализа характерна малая скорость реакций в начальный период, называемый периодом индукции, и быстрое нарастание выхода продукта в последующий период в результате возрастания количества катализатора. В дальнейшем выход продукта увеличивается согласно закону действующих масс, так же как и для обычных реакций.
Для возбуждения цепных реакций в исходную смесь обычно вносится вещество (инициатор), которое, реагируя с исходным веществом, вызывает зарождение цепи, т.е. образование первых свободных радикалов, и таким образом ускоряет реакцию подобно катализатору. Однако инициаторы в
отличие от типичных катализаторов расходуются в процессе реакции.
Гомогенный катализ
Гомогенный катализ может протекать в газовой или жидкой фазе. Механизм гомогенного катализа состоит в образовании между реагентами и катализаторами нестойких, промежуточных соединений, существующих в той же фазе (газовой или жидкой), после распада которых образуется продукт реакции, а катализатор регенерируется. В отличие от гетерогенно-каталитических реакций при гомогенных реакциях состав промежуточных соединений в ряде случаев можно выявить анализом. Процессы гомогенного катализа классифицируются:
Ø по типу взаимодействия между реагирующими веществами и катализатором на окислительно-восстановительные и кислотно- основные;
Ø по фазовому состоянию на жидкофазные (в растворах) и газофазные.
При выборе катализатора особое значение имеют его активность и селективность, доступность, относительно низкая стоимость, малая коррозионная способность, малое воздействие на окружающую среду.
Гомогенные катализаторы очень активны, но имеют определенные недостатки:
Ø сложность отделения катализатора от реакционной массы (отмывка, отгонка), при котором может образовываться большое количество токсичных или загрязненных сточных вод;
Ø сложность регенерации, что увеличивает долю катализатора в себестоимости продукции;
Ø коррозионность.
Катализаторами в растворах служат кислоты (катион Н+), основания (анион ОН -), ионы металлов (Ме+, Ме2+), а также вещества, способствующие образованию свободных радикалов.
Механизм кислотно-основного (ионного) катализа в растворах заключается в том, что идет обмен протонами между катализатором и реагирующими веществами, сопровождающийся внутримолекулярными превращениями. При кислотном катализе протон (или положительный ион) переходит сначала от катализатора к реагирующей молекуле, а при основном катализе катализатор служит вначале акцептором протона или донором аниона по отношению к молекуле реагента. В последующей стадии каталитической реакции протон перемещается в обратном направлении, и катализатор восстанавливает свой состав.
По такому типу протекают реакции гидратации, дегидратации, гидролиза, этерификации, поликонденсации в растворах. Примером кислотно-основного катализа в растворе может служить гидратация олефинов в спирты, катализируемая кислотами (НА).
В общем виде
RCH=CH2 + HA 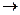 RCH2−CH
RCH2−CH 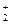 + A- (a)
+ A- (a)
RCH2−CH 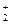 + HOH
+ HOH 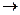 RCH2−CH2OH + H+ (б)
RCH2−CH2OH + H+ (б)
Н+ + А- 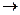 НА (в)
НА (в)
На стадии (а) катализатор служит донором протона; на стадии (в) катализатор регенерируется.
К ионным относятся и окислительно-восстановительные каталитические реакции в растворах, ускоряемые ионами металлов с переменной степенью окисления (меди, марганца, железа).
Газофазный гомогенный катализ (процесс, при котором и реагенты, и катализатор – газы) применяют сравнительно редко. Примером его могут служить дегидратация уксусной кислоты в парах при участии катализатора (парообразного тиэтилфосфата); окисление метана в формальдегид кислородом воздуха, ускоряемое оксидами азота.
Газофазний катализ может осуществляться по молекулярному и радикальному цепному механизму.
Ø При молекулярном механизме каталитической реакции происходит обмен атомами между катализатором и реагирующими веществами.
Ø Радикальный механизм гомогенного катализа возможен как в газовой, так и в жидкой фазе. Катализатор служит инициатором, направляющим реакцию по цепному механизму. Ускорение достигается в результате появления богатых энергией частиц – свободных радикалов в процессе самой реакции. По такому механизму протекают некоторые окислительные реакции в газах, полимеризация в жидкой фазе и т. п.
Скорость гомогенного каталитического процесса возрастает с повышением концентрации исходных веществ и катализатора согласно закону действующих масс.
Повышение давления ускоряет газовые реакции, так как с ростом давления увеличивается концентрация реагентов. Повышение температуры вызывает ускорение гомогенных реакций в соответствии с уравнением Аррениуса. Перемешивание имеет наибольшее значение для жидкостных процессов, так как скорости диффузии в жидкостях в десятки и сотни тысяч раз меньше, чем в газах. Перемешивание растворов позволяет сильно увеличить общую скорость процесса за счет снятия диффузионных торможений.
Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси (жидкости или газа), в результате чего часть катализатора теряется безвозвратно, а продукт загрязняется им.
Дата добавления: 2017-11-04; просмотров: 5229;
