Возможности и направления экспериментального мутагенеза
Экспериментальный мутагенез в селекции лесных древесных растений развивается благодаря работам ряда отечественных и зарубежных исследователей. В настоящее время он используется в двух направлениях: агротехническом и генетико-селекционном.
При агротехническом направлении индуцируется модификационная изменчивость, или ненаследственные изменения фенотипа, определенные генотипически обусловленной нормой реакции. При этом достигаются эффекты повышения всхожести семян, сокращения периода покоя и сроков стратификации семян; усиление ростовых процессов; увеличение выхода высококачественного посадочного материала (стандартных сеянцев); стимуляции плодоношения, ризогенеза, смоловыделения и усиления других полезных свойств древесных растений. В этом случае чаще всего мутагены используют в слабых концентрациях и дозах. При генетико-селекционном направлении применяют мутагены в более сильных концентрациях и дозах. В этом случае стремятся индуцировать мутационную изменчивость и усилить формообразовательный процесс с целью получения ценного исходного материала и мутантных форм с хозяйственно ценными признаками.
К настоящему времени, по данным ряда авторов, у разных пород (клена, тополя, сосны, березы, дуба, липы, ореха, биоты и др.) получены ценные для лесного хозяйства и зеленого строительства формы. Среди них представляют интерес быстрорастущие, зимостойкие, устойчивые к болезням, а также декоративные формы: карликовые, с нетипичной для данного вида формой кроны (плакучие, стелющиеся, пирамидальные и др.), с различной величиной, формой и окраской листьев (Г.Ф. Привалов, 1965, 1968,1974; Е.М. Гуляева и др., 1981; Ф.Л. Щепотьев, 1982; О.С. Машкина, 1995 и др.).
При искусственном получении мутаций генетики опираются на закон Н.И. Вавилова о гомологических рядах в наследственной из менчивости. Почти все формы, возникающие при искусственном мутагенезе, можно найти в природе, если они не элиминируются отбором. Значение индуцированного мутагенеза состоит в существенном увеличении частоты и спектра этих мутаций, а также в получении форм с комплексом хозяйственно ценных признаков. Для получения искусственных мутаций используют две основные группы методов: физических и химических.
5.2.2. Физические методы получения мутантов
Среди физических мутагенов чаще всего используют излучения различного типа. Они бывают двух видов: ионизирующие и неионизирующие.
Ионизирующие излучения. Рентгеновское, гамма- и нейтронное излучения называются ионизирующими за способности превращать атомы и молекулы в электрически заряженные частицы — ионы,' т.е. вызывать ионизацию.
Рентгеновское излучение начали применять первым в мутагенезе, его используют широко и в настоящее время, поскольку рентгеновские аппараты имеются во многих учреждениях, ими просто управлять, рентгеновским излучением относительно легко воздействовать как на семена, так и на другие части растений, несложно менять дозы облучения.
Источником гамма-излучения обычно служит радиоактивный кобальт (60Со) или цезий (l37Cs). На объект воздействуют двумя способами обработки: острым (мощное кратковременное излучение) и хроническим (длительное, но значительно более слабое).
Нейтронное излучение возникает в результате ядерных реакций. В частности, при делении ядер урана и плутония. Различают быстрые нейтроны (энергия ионообразования 0,2-26 МэВ) и медленные, или тепловые (энергия 0,0025 эВ). Быстрые нейтроны оказывают мутагенное воздействие преимущественно в момент облучения, тепловые — вызывают наведенную радиоактивность в самой клетке. Относительная биологическая эффективность нейтронов в 10-40 раз выше, чем гамма- и рентгеновского излучения.
Радиоактивные изотопы. В качестве мутагенных факторов можно применять также радиоактивные изотопы фосфора (32Р) и серы (35S), у которых период полураспада составляет соответственно 14,3 и 87,1 дня. Частота появления мутации зависит от дозы облучения. Однако эта пропорциональная зависимость наблюдается только в интервале 100%-ной выживаемости. С переходом в интервал от ЛД0 до ЛД|000 (ЛД0 — порог выживаемости, ЛД|000 — гибель всех растений) пропорциональность нарушается за счёт гибели облучаемых растений. За критическую обычно принимают такую дозу, при воздействии которой выживает 30-40 % растений (ЛД30 40).
Неионизирующие излучения. Генетически эффективным неионизирующим излучением считается ультрафиолетовое (УФ). Оно имеет большую длину волны (200-400 нм), чем ионизирующие излучения, и меньшую энергию. При его воздействии происходит не ионизация вещества, а только возбуждение молекул. Проникающая способность УФ очень мала, его используют только для обработки пыльцевых зерен.
Лазерное излучение также производит мутагенный эффект. Показано, что при воздействии на семена и вегетирующие растения импульсным и непрерывным (в том числе и низко интенсивным) лазерным излучением видимой области спектра можно получить высокий выход мутантных форм (Ю. Гужов и др., 1991).
Первые опыты по использованию рентгеновских лучей для вызывания мутаций у лесных древесных пород были проведены В.Н. Сукачевым на ивах в 1933 г. Облучались черенки (более 5000), семена и цветки. Им было установлено, что большие дозы облучения безвредны для черенков и летальны для семян. При этом сильные дозировки даже стимулировали рост побегов и черенков. По результатам опытов с облучением черенков были описаны две мутации по листьям: узколистость и курчавость, обнаруженные у четырех видов ивы. В эти же годы И. Никитиным установлено стимулирующее влияние рентгеновских лучей на всхожесть семян березы и сосны и прорастание пыльцы липы.
В 50-х годах М.А. Кудинов в Белоруссии провел большое многолетнее исследование по изучению влияния ионизирующих излучений на лесные растения. В опытах изучено 49 видов лесных и декоративных деревьев и кустарников. Установлены стимулирующие Прорастание семян дозы и летальные. Показана очень высокая радио устойчивость семян у некоторых кустарников. Так, ракитник русский и барбарис амурский имели повышенную всхожесть семян При их облучении 60000 рад. Хвойные породы, особенно ель обыкновенная, имели низкую всхожесть уже при 100 и 200 рад.
Г.Ф. Привалов (1965, 1968, 1974) проводил облучение семян у- и рентгеновскими лучами. Им установлены критические дозы облучения для 30 видов древесных растений. Наиболее радиочувствительными оказались семена хвойных (сосна сибирская, лиственница, сосна, ель), березы и ольхи. Для этих видов растений критические дозы (ЛД75) лежат в пределах 2-6 кР. Наиболее устойчивыми (критическая доза более 20 кР) оказались семена облепихи, гледи чии, тополя. В результате опытов не только с семенами, но и с растениями получен ряд мутантных форм.
Ф.Л. Щепотьевым в Донецком ботаническом саду выведены многочисленные мутанты дуба, тополя, каштана конского, биоты восточной, шиповника, айвы японской, облепихи и других пород. Мутанты плодоносят, в результате чего получено второе поколение М2. У дуба черешчатого при обработке гамма-лучами Со60 дозами от 103 до 6-Ю3 рад выделены мутантные формы по характеру крон и особенностям роста: плакучая, пирамидальная, флаговидная, чашевидная, стелющаяся, карликовая, кустарниковая, быстрорастущая. Рост некоторых опытных растений дуба в семилетнем возрасте превышал контрольные по высоте и диаметру в 2-3 раза. У клена серебристого после облучения семян гамма-лучами дозами 579, 1158 и 1544 рад в 10-летнем возрасте выделены следующие формы: Донецкий ботанический — пестро-золотистая декоративная форма, пушистый, плакучий с поникающими ветвями и разрезно-узколопастными листьями, краснолистный. У тополя волосистоплодного в результате облучения черенков гамма-лучами дозами 50-150 рад выделен пестролистный мутант — Донецкий золотой. При облучении гамма-лучами Со60 шиповника получены следующие результаты. Дозы облучения от 3 до 10 кР стимулировали всхожесть, а высокие дозы (18-21 кР) понижали ее. Выделены мутанты с различной крупностью плодов, формой листьев, повышенным содержанием аскорбиновой кислоты в плодах и масла в семенах, а также растения без шипов на побегах и листьях (Ф. Л. Щепотьев, 1982).
Таким образом, работы с физическими мутагенами показали возможность их использования в практических целях для получения декоративных и быстрорастущих форм лесных древесных пород.
5.2.3. Химические методы получения мутантов
Химические мутагены по их действию делят на пять классов:
• ингибиторы азотистых оснований, входящих в состав нуклеиновых кислот; их действие заключается в подавлении синтеза гуанина и тимина;
• аналоги азотистых оснований, входящие также в нуклеиновые кислоты; они включаются в ДНК на место тимина;
• алкилирующие соединения, вызывающие нарушение точности авторепродукции молекул ДНК;
• окислители, восстановители и свободные радикалы, вызывающие замену в молекуле ДНК пар оснований А-Т на Г-Ц;
• акридиновые красители, образующие в результате реакции с ДНК комплекс, препятствующий нормальной редупликации.
Наиболее распространенными и широко используемыми в последние десятилетия в России являются алкилирующие соединения, в частности супермутагены. К ним относятся этиленимин (ЭИ), диэтилсульфат (ДЭС), диметилсульфат (ДМС), нитрозоэтилмочевина (НЭМ), нитрозометилмочевина (НММ) и др.
Чувствительность растений к мутагенам можно оценивать по энергии прорастания и всхожести семян, выживаемости растений, энергии роста, частоте и спектру хромосомных нарушений в первом митозе в клетках проростков. Для получения наибольшего количества полезных мутаций рекомендуется брать концентрации близкие к критическим.
Химические мутагены применяют в виде водных растворов различной концентрации (обычно 0,01-0,2% в течение 18-24 ч) или в газовой фазе. Чаще воздействию подвергают различные вегетативные органы — семена, черенки, почки и т. п. Недостатком этого способа воздействия являются частое возникновение химерных растений, содержащих мутантные и немутантные ткани, и невысокая эффективность из-за гибели обработанного материала, особенно при средних и жестких концентрациях, что ведет к потере значительного количества мутаций.
Эффективность действия мутагенов зависит от многих факторов, в частности: особенностей генотипа, способа воздействия, вида мутагена, его концентрации (дозы) и экспозиции, кислотности и температуры раствора, обрабатываемого органа, его физиологического состояния в момент обработки и др. Как и при физических воздействиях, при химической обработке черенки обычно более устойчивы к мутагенам, чем семена. Набухшие семена чувствительнее сухих. Генеративные органы чувствительнее вегетативных. Полиплоиды устойчивее диплоидов. Поэтому в каждом конкретном случае оптимальные режимы воздействия подбираются экспериментальным путем. Полезные мутации возникают крайне редко, не более одной-двух на тысячу мутаций.
Индуцирование химических мутантов лесных древесных пород начало широко применяться в разных регионах с середины 60-х го-дон. В Донецком ботаническом саду Ф.Л. Щепотьевым получены декоративные и быстрорастущие формы дуба черешчатого (стелющиеся, плакучие, колонновидные и др.), биоты восточной (с пирамидальной, яйцевидной, шаровидной и овальной кроной) и других i к >род. В НИИ лесной генетики в Воронеже Е.М. Гуляевой, О.С. Машкиной и другими сотрудниками получены хемомутанты сосны обыкновенной и тополя бальзамического. У сосны — быстрорастущие, равноплодоносящие, треххвойные, редкохвойные и др. У тополя — быстрорастущие, пирамидальные, плакучие и др. Интересные результаты с сосной обыкновенной получены Е.Н. Самошкиным в Брянске (Ф.Л. Щепотьев, 1982; О.С. Машкина, 1995; Е.Н. Самошкин, 1986).
5.3. Экспериментальная полиплоидия лесных древесных пород
Для искусственного получения полиплоидов используют различные факторы воздействия: физические (температура, ионизирующие излучения), химические (колхицин, хлороформ, закись азота, супермутагены и др.) и механические (декапитация). По способу получения полиплоиды делятся на митотические, мейотические и зиготические (М.Е. Лобашов, 1967; Е.П. Раджабли и др., 1967; А.И. Колесников, 1972; О.С. Машкина, 1995).
Митотические полиплоиды возникают из соматических клеток при воздействии полиплоидогенными веществами (колхицином и др.) на вегетативные части растений (семена, точки роста, проростки и т. п.) при погружении их в раствор, помещении под капли раствора мутагена, наложении на них ватного тампона, инъекции и т.п.
Эффективность полиплоидизации в значительной степени определяется генетическими особенностями обрабатываемого материала, стадией его развития в момент обработки, способами обработки, концентрацией и температурой применяемого раствора, продолжительностью воздействия. Оптимальные условия обработки устанавливают для каждого объекта опытным путем. Метод обработки семян дает лучшие результаты у быстрорастущих растений — осины, тополя и др.
Недостаток этого способа — возникновение преимущественно миксоплоидных растений (т.е. особей, содержащих в различном соотношении клетки и ткани разного уровня плоидности, в частности диплоидных и тетраплоидных). При достаточно высоком содержании диплоидных клеток (до 50% и выше) в таких миксоплоидах появляется опасность их деполиплоидизации, т.е. возвращения растения на исходный диплоидный уровень. Поэтому для сохранения полиплоидной ткани необходима дополнительная работа по расхимериванию, для чего срезают растения на пень, удаляют диплоидные быстрорастущие ветви, стимулируя развитие более медленнорастущих тетраплоидных побегов.
Мейотические полиплоиды возникают от участия в гибридизации нередуцированных диплоидных, триплоидных и даже тетраплоидных гамет. Продуцентами таких гамет могут быть полиплоидные или му тантные диплоидные растения. Возникающие при этом полиплоиды будут устойчивыми, цитологически стабильными. Мейотические полиплоиды можно получать различными путями, в частности:
• выявлением, отбором и вовлечением в скрещивание естественных или искусственно полученных мутантных диплоидных форм с генетически обусловленной склонностью к формированию диплоидных гамет;
• гибридизации на разнохромосомном уровне и при свободном опылении полиплоидов 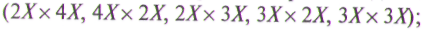
• искусственным получением диплоидной пыльцы с последующим использованием её в гибридизации с диплоидными растениями; такую пыльцу у древесных растений получают с помощью колхицина, низкой и высокой температуры, ионизирующей радиации, химических супермутагенов или собирают с природных деревьев-продуцентов (чаще всего гибридов) нередуцированой пыльцы.
Зиготические полиплоиды получают путем полиплоидизации зиготы в период её первого деления. Такие полиплоиды получены колхицинированием у видов рода Populus.
Способ получения полиплоидов откладывает отпечаток на их многие показатели. Полиплоиды, полученные в сочетании с гибридизацией (мейотические и зиготические), более гетерозиготны, сбалансированы, фертильны и продуктивны, а поэтому более пригодны для селекции, чем митотические, возникшие за счет простого умножения числа хромосом, содержащихся в вегетативных частях растений.
На первых этапах развития полиплоидные растения отличаются от своих диплоидных собратьев по следующим признакам: угнетенный или мощный рост; наличие листовых пластинок, сидящих на утолщенных коротких черешках; появление кожистых листьев темно-зеленой окраски; присутствие морщинистых асимметричных листовых пластинок; увеличенные размеры устьичных клеток и уменьшенное их количество на единицу площади листа; большое количество хлоропластов в замыкающих клетках устьиц; большие размеры пыльцевых зерен и большее число пор на их экзине. Окончательный отбор полиплоидов проводят только на основании прямого подсчета числа хромосом в их соматических клетках. Свойства экспериментальных полиплоидов лесных древесных растений Могут проявиться не сразу, а постепенно в течение онтогенеза. Поэтому изучение и отбор индуцированных растений должны проводиться на протяжении нескольких лет.
Ф.Л. Щепотьев (1982) отмечает, что первые тетраплоиды у сосны были получены Мировым и Стокуэллом в 1939 г. Затем в опытах Н. Jensen and A. Levan были выделены тетрашюиды секвойи гигантской. Д.А. Комиссаров получил триплоидные растения у сосны обыкновенной. В бывшей ГДР в результате колхицинирования семян выявлены тетраплоиды у ели обыкновенной, а у девяти видов пихты получены как тетраплоиды, так и октоплоиды.
Значительно шире полиплоидия распространена среди лиственных пород. Особенно много полиплоидных форм отмечено в семействах Salicaceae, Betulaceae, Rosaceae, Fagaceae и др. Ниже приведены данные по получению спонтанных (найденных в природе) и индуцированных полиплоидов у некоторых древесных пород.
Особый интерес представляет исследование полиплоидии рода дуба из семейства Fagaceae. У большинства его видов галоидное число хромосом равно 12, а диплоидное — 24. Однако у ряда североамериканских видов дуба (каштановый, виргинский, мерилендский, Мишо) гаплоидное число хромосом равно 6, а диплоидное 12. Наличие в роде Quercus двух разных групп по кариотипу позволяет предположить, что виды с 2л = 24 являются тетраплоидами, а с 2n =12 — диплоидами. Следовательно, считающийся диплоидным Q. robur L. должен бы рассматриваться как тетраплоид. Спонтанные полиплоиды дуба черешчатого возникают также из многозародышевых желудей. Впервые триплоиды такого типа были замечены в Швеции. В Воронежской области естественный триплоид дуба был обнаружен В.В. Иевлевым (В.В. Иевлев и др., 1978). Исследования, проведенные в лесах Донецкой области, показали, что встречаемость спонтанных триплоидов среди проростков дуба черешчатого может достигать 1,2%.
Искусственная полиплоидизация дуба черешчатого с помощью колхицина была проведена в Швеции в 1939 г. При этом были получены миксоплоидные ткани с тетраплоидными (4 п =48) клетками. Близкие результаты получены и Ф.Л. Щепотьевым.
В семействе Salicaceae наиболее известны спонтанные триплоиды осины. Выделены спонтанные и искусственно полученные полиплоиды у тополей белого, сереющего, черного и бальзамического, а также у ряда ив. Некоторые данные по полиплоидам можно найти в разделах, посвященным частной селекции этих пород.
В семействе Betulaceae полиплоиды встречаются в родах березы, ольхи и граба. Так, береза пушистая, распространенная в более суровых условиях севера России, является тетраплоидом (4л = 56), в то время как более южный вид (береза повислая) относится к диплоидам (2n = 28). Другие северные виды обладают еще более высокой плоидностью. Так, береза желтая (В. lenta) — гексаплоид (6и = 84), даурская — септаплоид (7n = 98). В естественных насаждениях встречаются также триплоидные формы. С помощью колхицина X. Йонссон в Швеции получил тетраплоидные растения ольхи черной. Последующим скрещиванием с диплоидными растениями он создал триплоидные формы, которые превосходили диплоидные контрольные растения ольхи черной по продуктивности древесины на 55%.
Полиплоидные формы выделены также среди представителей семейств конскокаштановых, кленовых, липовых, лоховых (облепиха) и др. (Г.Ф. Привалов, 1974; Ф.Л. Щепотьев, 1982; Н.С. Щапов, В.К. Креймер, 1988). Во многих случаях они представляют практический интерес.
5.4. Селекция методом культуры клеточных тканей и клеток
Введение культуры клеточных тканей и клеток (метод in vitro) может способствовать созданию лучших сортов, более быстрому использованию ценного материала и уникальных форм. В стерильную культуру тканей и клеток в принципе возможен перевод всех частей растений, однако для исследований в области селекции имеет значение культура только таких органов, в которых можно индуцировать органогенез. К ним можно отнести верхушки побегов (апикальная меристема и дифференцированные ткани побега); цветковые почки, завязи, семяпочки; пыльники, пыльца; зародыш; клетки; ткань каллуса.
Применение метода охватывает следующие этапы работы: выбор подходящего для решения поставленной задачи сорта (генотипа) и нужной части растения для закладки культуры; закладка стерильной культуры; создание условий (питательная смесь, температура, освещение и др.) для стимуляции желательного процесса развития; регенерация жизнеспособных растений; перевод отобранных для селекции растений в грунтовую культуру для включения их в дальнейший селекционный процесс.
Задачи, решаемые этим методом в селекции, можно сгруппировать в три взаимно связанные группы: 1) расширение генетической базы селекции растений путем получения нового исходного материала; 2) сохранение и размножение ценных элитных растений и линий; 3) получение и сохранение безвирусного материала растений. Ниже перечислены некоторые конкретные методы, которые можно использовать для решения этих задач.
Расширение генетической базы для селекции растений. Обычные Методы селекции, основанные на внутривидовой гибридизации и отборе, как правило, ведут к обеднению генетической изменчивости и сужению генетической базы, что влечет за собой потерю устойчивости создаваемых генотипов и их популяций. Эффективность селекции в будущем можно обеспечить только путем постоянного расширения ее генетической базы, что можно осуществить методами культуры тканей и клеток. Для этого используют методы соматической межвидовой гибридизации, оплодотворения и эмбрио-культуры, культуры пыльников, пыльцы и отдельных клеток in vitro и сомаклональной селекции.
Сохранение и размножение in vitro ценных элитных растений и линийприменяется с целью получения генетически идентичных клонов. При этом обеспечивается:
• сохранение и размножение отдельных генотипов как исходных форм для решения специфических селекционных задач;
• быстрое эффективное размножение новых ценных сортов;
• сохранение и эффективное размножение линий для производства гибридных семян растений;
• экономичное размножение высокопродуктивных генотипов лесных пород, декоративных древесных растений и подвоев плодовых культур;
• размножение в стерильных условиях при получении безвирусного материала;
• сохранение сортимента вегетативно размножающихся культур и важнейших перекрестноопыляющихся растений.
Для осуществления этих задач используются методы клонирования на основе меристем верхушек побегов в стерильных условиях, а также регенерации жизнеспособных растений из других органов (стеблей, кусочков листа, органов цветка, луковиц и др.).
Получение и сохранение безвирусного материала. Эти методы получили распространение в практике сельского хозяйства для освобождения от вирусов вегетативно размножаемых растений. Установлено, что концентрация вирусов в растении снижается по мере приближения к конусу нарастания. Сам конус нарастания часто бывает свободным от вирусной инфекции. Это и было использовано для оздоровления материала путем изолирования меристемы в стерильных условиях и доведения ее до дифференциации in vitro. Изоляция меристемы размером 0,05-0,1 мм очень сложна. И успех дифференциации растений из нее невелик. Поэтому вместе с ней изолируют первые листовые примордии и тогда говорят о верхушке побега, которая имеет размер 0,1-1 мм. Благодаря этому хотя и ограничивается надежность получения безвирусного материала, но зато повышается степень его дифференциации. Кроме того метод становится удобным для практического использования. Культивирование производят на питательных средах Мурасиге и Скуга (см. табл. 10.1), Байса, Уайта и Хеллера.
Кратко рассмотренные в настоящем разделе методы широко распространены в мире и продолжают совершенствоваться. Так, по некоторым данным (Г.П. Бутова, 1995 и др.), к началу 90-х годов в 15 странах Европейского сообщества работало более 250 лабораторий культуры in vitro, из которых примерно половина в коммерческих целях. Из 550 возделываемых in vitro видов значительное количество составляли древесные и кустарниковые. При этом розой занимались в 45 лабораториях, рододендроном — в 25, березой — в 19, дубом — в 18, тополем — в 12, сосной и елью — в 15.
В США насчитывается 270 промышленных лабораторий, в том числе и по древесным породам. В середине 80-х продукция растений, размноженная методом культуры тканей, составила: 50 млн штук в США, 53 млн штук в Голландии, 10 млн штук в ФРГ, около 28 млн штук в Италии.
В бывшем СССР и в России получением селекционного материала этими методами успешно занимались ряд научных лабораторий Москвы, Санкт-Петербурга, Воронежа, Уфы, Мичуринска и др. Однако в последние годы масштабы исследований сократились, хотя перспективность их остается несомненной.
В целом, культура тканей предоставляет новые возможности для повышения эффективности селекции растений. Кроме того, с ее помощью можно создавать новые ценные сорта.
* *
Методы селекции лесных древесных пород, описанные в настоящей главе, начали развиваться относительно недавно. Поэтому они и названы в отличие от отбора и гибридизации, нетрадиционными. Стартовые исследования для части из них были начаты в первой половине XX века, но основные успехи достигнуты во второй половине этого века. В последние годы получила развитие идея сочетания традиционных и нетрадиционных методов для более успешного выведения хозяйственно ценных форм.
Однако, несмотря на прогресс селекции, достигаемый этими методами, широкому их практическому использованию препятствует ряд проблем. Они заключаются в том, что эти методы довольно дорогие, требуют специально оборудованных лабораторий, приборов и расходных материалов. Кроме того, как и для новых гибридов и отдельно отобранных лучших деревьев, существуют трудности массового размножения ценных форм трудно черенкующихся видов. С другой стороны, использование метода культуры клеток и клеточных тканей позволит преодолеть и этот барьер. Например, успешные опыты по клеточной репродукции дуба проведены во Франции. Поэтому необходимы более активные усилия по разработке методов вегетативного и клонального микроразмножения трудно черенкующихся форм лесных древесных пород.
Одним из способов преодоления проблемы является также создание биклоновых семенных плантаций из диплоидных и тетраплоидных растений с целью получения хозяйственно ценных триплоидных форм. В будущем возможна разработка и других эффективных методов сохранения и размножения ценных генотипов лесных древесных пород, выведенных нетрадиционными методами селекции.

Вопросы для самопроверки
1. Охарактеризуйте виды мутаций, используемые в селекции.
2. Что такое полиплоидия и её возможности в селекции лесных древесных пород?
3. Дайте краткую характеристику метода культуры тканей и его использования в селекции лесных древесных пород.
4. Покажите возможности и направления экспериментального мутагенеза.
5. Опишите физические методы получения мутантов, ионизирующие и неионизирующие излучения.
6. Приведите результаты, полученные у лесных древесных пород при использовании физических методов мутагенеза.
7. Охарактеризуйте химические методы получения мутантов, приведите классификацию мутагенов и результаты их применения у лесных древесных пород.
8. Опишите экспериментальную полиплоидию лесных древесных пород. Приведите характеристики митотического, мейотического и зиготического методов получения полиплоидов.
9. Что такое спонтанные и индуцированные полиплоиды лесных древесных пород? Приведите примеры.
10. Охарактеризуйте селекцию методом культуры клеток и клеточных тканей in vitro: этапы, задачи и методы.
11. Приведите некоторые результаты использования методов культуры тканей у лесных древесных пород.
12. Укажите основные проблемы практического использования нетрадиционных методов селекции и пути их преодоления.
Глава 6
Генетическая оценка селекционного материала и сортоиспытание
Основным способом установления генетической ценности селекционного материала является испытание по семенному и вегетативному потомству на специальных испытательных и сортоиспытательных культурах. Объектами испытания могут быть отдельные деревья (плюсовые деревья, гибриды, мутанты и т.п.); популяции (насаждения, экотипы, географические происхождения, интродуценты и т.п.); сорта (сорта-клоны, сорта-популяции, сорта-гибриды и др.).
6.1. Особенности испытания и генетической оценки лесных древесных пород
Дата добавления: 2017-01-13; просмотров: 2614;
